
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория поля лигандов
|
|
|
|
Комплексообразователем может быть не только положительный ион металла, но и металл в нулевой степени окисления, например, в карбонилах металлов - соединениях с общей формулой [M(CO)n]. Связь в таких соединениях можно объяснить с позиций МВС в рамках правила 18 электронов: устойчивы такие карбонилы, в которых все d-, s- и p-орбитали металла заполнены электронными парами. Стабильны карбонилы [Cr(CO)6], [Fe(CO)5], [Ni(CO)4]. У пентакарбонилжелеза [Fe(CO)5] - d1sp3-гибридизация. Если металл имеет нечетное число электронов, то карбонилы димерны: [Mn(CO)5]2, [Co(CO)4]2.
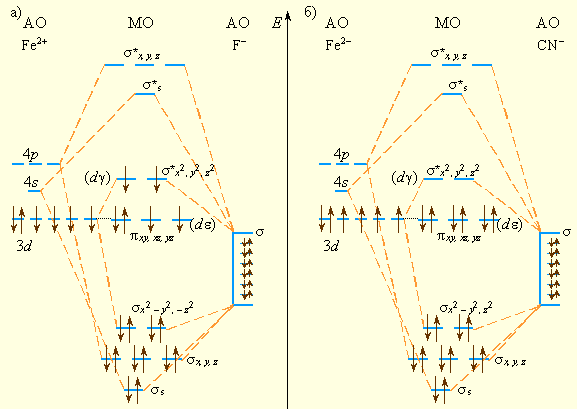
Метод молекулярных орбиталей применительно к координационным соединениям позволяет более строго описать их электронное строение и называется теорией поля лигандов (ТПЛ). Рассмотрим октаэдрический комплекс [ML6]n-, в котором каждый ион L- способен образовать только одну?-связь с центральным атомом. Шесть?-орбиталей лигандов объединяются в шесть групповых орбиталей, каждая из которых может перекрываться только с одной из шести АО металла, направленных к вершинам октаэдра: dx²-y², dz², px, py, pz и s. Каждое попарное перекрывание приводит к образованию одной связывающей и одной разрыхляющей МО. Орбитали dxy, dxz, dyz (d?) не направлены к вершинам октаэдра, поэтому они не могут участвовать в образовании?-МО и остаются несвязывающими (рис. 9.6). Электронные пары лигандов занимают связывающие МО, а d-электроны могут занять несвязывающие (?) и разрыхляющие?*-орбитали.
 1 1
|
| Рисунок 9.6 Схемы МО октаэдрических комплексов: высокоспинового [FeF6]4- (a) и низкоспинового [Fe(CN)6]4- (б) |
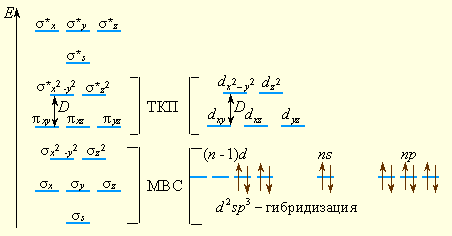
В отличие от ТКП здесь более обоснована стабильность комплексного иона, определяющаяся, главным образом, энергией образования шести двухэлектронных связей. Разность между несвязывающими?-МО и разрыхляющими?*-МО соответствуют параметру расщепления?. На этих пяти орбиталях размещаются d-электроны комплексообразователя, причем в зависимости от величины параметра расщепления? возникают как высокоспиновые комплексы - [FeF6]4-(?)4(?*)2, так и низкоспиновые - [Fe(CN)6]4-(?)6. В рамки ММО укладываются и ТКП (расщепление d-орбиталей на dε и dγ), и МВС, поскольку связывающие орбитали уже не являются чистыми орбиталями лигандов, а принадлежат и центральному атому (рис. 9.7).
 2 2
|
| Рисунок 9.7 Сопоставление ММО, МВС и ТКП применительно к октаэдрическому комплексу d-элемента |
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 651; Нарушение авторских прав?; Мы поможем в написании вашей работы!