
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электронная конфигурация комплексообразователя
|
|
|
|
Устойчивость, реакционная способность и многие физические свойства координационных соединений 3d-металлов во многом определяются электронной конфигурацией комплексообразователя, симметрией координационного полиэдра и значениями констант образования, определяющих стандартную величину окислительно-восстановительного потенциала.
|
Откуда

|
Для одного и того же комплексообразователя окислительно-восстановительный потенциал может существенно изменяться; этим достигается стабилизация требуемой степени окисления центрального иона. В табл. 9.3 приведены степени окисления 3d-металлов в координационных соединениях.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Таблица 9.3 Степени окисления 3d-металлов в координационных соединениях |
Электронные конфигурации во многом предопределяют свойства и строение координационных соединений 3d-металлов. 3d0 (Sc3+, Ti4+, V5+, Cr6+, Mn7+) обычно образуют тетраэдрические тетраоксоанионы (
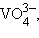
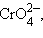
 ) и октаэдрические [ScF6]3-, [TiF6]2-, [VF6]-. 3d1 (Ti3+, V4+ или VO2+, Cr5+, Mn6+), соединения Ti3+ обычно имеют октаэдрическое строение [TiCl6]3-, [Ti(H2O)6]3+, в водных растворах V4+ не существует, переходя в ванадил-ион с искаженной октаэдрической структурой [VO(H2O)5]2+. Соединения Cr5+ и Mn6+ обычно известны в виде анионов
) и октаэдрические [ScF6]3-, [TiF6]2-, [VF6]-. 3d1 (Ti3+, V4+ или VO2+, Cr5+, Mn6+), соединения Ti3+ обычно имеют октаэдрическое строение [TiCl6]3-, [Ti(H2O)6]3+, в водных растворах V4+ не существует, переходя в ванадил-ион с искаженной октаэдрической структурой [VO(H2O)5]2+. Соединения Cr5+ и Mn6+ обычно известны в виде анионов  и
и 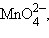 которые в водной среде диспропорционируют. 3d2 (Ti2+, V3+, Cr4+, Mn5+, Fe6+). В водных растворах они неустойчивы: [Ti(H2O)6]2+ - сильнейший восстановитель,
которые в водной среде диспропорционируют. 3d2 (Ti2+, V3+, Cr4+, Mn5+, Fe6+). В водных растворах они неустойчивы: [Ti(H2O)6]2+ - сильнейший восстановитель, 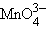 и
и  - сильнейшие окислители. Они в этих степенях окисления существуют только в твердом состоянии. 3d3 (V2+, Cr3+, Mn4+). Из них наиболее устойчив Cr3+ в октаэдрических комплексах, которые относятся к инертным соединениям независимо от вида комплекса (катионного, анионного или нейтрального). Они интенсивно окрашены, поскольку основные полосы поглощения находятся в видимой области. 3d4 (Cr2+, Mn3+). В водных растворах гексааквакомплексы [Cr(H2O)6]2+ и [Mn(H2O)6]3+ неустойчивы; первый окисляется до [Cr(H2O)6]3+, а второй диспропорционирует 2Mn3+> Mn2+ + Mn4+. Стабилизируют эту электронную конфигурацию двойные соли M2ISO4CrSO46H2O (M = NH4+, Na+, K+, Rb+, Cs+), в которых Cr2+ остается высокоспиновым (S = 2) и бидентатные лиганды (dipy - дипиридил и phen - фентантролин). Комплексы [Cr(dipy)3]X2 и [Cr(phen)3]X2 (X = Cl, Br, I) оказываются низкоспиновыми (S = 1). В моногидрате ацетата Cr (II) стабилизация электронной конфигурации обусловлена димеризацией (рис. 9.8).
- сильнейшие окислители. Они в этих степенях окисления существуют только в твердом состоянии. 3d3 (V2+, Cr3+, Mn4+). Из них наиболее устойчив Cr3+ в октаэдрических комплексах, которые относятся к инертным соединениям независимо от вида комплекса (катионного, анионного или нейтрального). Они интенсивно окрашены, поскольку основные полосы поглощения находятся в видимой области. 3d4 (Cr2+, Mn3+). В водных растворах гексааквакомплексы [Cr(H2O)6]2+ и [Mn(H2O)6]3+ неустойчивы; первый окисляется до [Cr(H2O)6]3+, а второй диспропорционирует 2Mn3+> Mn2+ + Mn4+. Стабилизируют эту электронную конфигурацию двойные соли M2ISO4CrSO46H2O (M = NH4+, Na+, K+, Rb+, Cs+), в которых Cr2+ остается высокоспиновым (S = 2) и бидентатные лиганды (dipy - дипиридил и phen - фентантролин). Комплексы [Cr(dipy)3]X2 и [Cr(phen)3]X2 (X = Cl, Br, I) оказываются низкоспиновыми (S = 1). В моногидрате ацетата Cr (II) стабилизация электронной конфигурации обусловлена димеризацией (рис. 9.8).
 1 1
|
| Рисунок 9.8 Димер моногидрата ацетата хрома (II) |
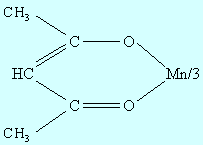
Межатомное расстояние Cr-Cr (0,264 нм) обусловлено образованием четверной связи между атомами хрома за счет всех четырех d-электронов. Соединения Mn (III) стабильны с лигандами, образующими металлоцикл, в частности с ацетилацетоном
|
|
или с тетрадентатными плоскими лигандами типа N'N'-этилен-бис(салицилиденимином), в которых Mn(III) стабилизируется в результате димеризации с образованием?-оксо соединения -?-оксо-[N'N'этилен-бис(салицилидениминат) марганца (III)]
 4 4
|
| Рисунок 9.11 ?-оксо[N,N'-этилен-бис(салицилидениминат) марганца(III)] |
3d5 (Mn2+, Fe3+). Октаэдрические комплексы устойчивы как в водных, так и неводных растворах. С лигандами слабого поля они образуют высокоспиновые комплексы - [Fe(H2O)6]Cl3, K3[FeF6], с лигандами сильного поля - низкоспиновые комплексы: K3[Fe(CN)6], K4[Mn(CN)6]. 3d6 (Fe2+, Co3+, реже Ni4+). Электронной конфигурации 3d6 в октаэдрическом окружении энергетически выгодно образование низкоспиновых комплексов (энергия стабилизации кристаллическим полем наибольшая - 2,4?окт); только слаболигандные комплексы остаются высокоспиновыми - [FeF6]4- и [CoF6]3-. 3d7 (Co2+, реже Ni3+). Октаэдрические комплексы Co(II) в водных растворах менее стабильны, чем тетраэдрические. Это обусловлено более симметричным размещением электронов на расщепленных полем лигандов d-орбиталях: 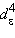
 (
(
 ) в октаэдре и
) в октаэдре и 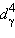
 (e4
(e4 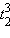 ) в тетраэдре. Октаэдрические комплексы Ni3+ получены только в примесных кристаллах, в которых Ni3+ занимает место Al3+. 3d8 (обычно Ni2+). В многочисленных октаэдрических комплексных ионах - [Ni(H2O)6]2+, [Ni(NH3)6]2+, [Ni(NO2)6]4- - Ni2+ сохраняет два неспаренных электрона. Если же образуются плоские четырехкоординационные (квадратные) комплексы типа [Ni(CN)4]2-, то они не содержат неспаренных электронов (S = 0) из-за того, что понижение симметрии от октаэдрической до квадратной приводит к расщеплению трехкратновырожденного уровня (dε, t2g) на дву- и однократный (синглетный), а двукратновырожденный уровень (dγ, eg) - на два синглета. В результате самый высокоэнергетический синглетный уровень оказывается незаселенным. 3d9 (Cu2+). Ионы Cu2+ образуют многочисленные координационные соединения с координационными числами шесть, пять и четыре: [Cu(H2O)6]2+, [CuCl5]3-, [Cu(NH3)4]2+ или [CuCl4]2-. Единственный неспаренный электрон сохраняется независимо от симметрии. Моногидрат ацетата меди (II) в кристаллическом состоянии изоструктурен моногидрату ацетата хрома (II) (рис. 9.8). В бис(?-диацетато-0'0'-аква) димеди (II) ионы меди (II) связаны слабой?-связью, результатом которой является молекулярный антиферромагнетизм, объясненный впервые при интерпретации необычных спектров электронного парамагнитного резонанса. 3d10 (Cu+, Zn2+). Ион Cu+ обычно является двухкоординационным [CuCl2]-, [Cu(NH3)2]+, а Zn2+ в зависимости от лигандов может быть тетраэдрическим [Zn(CN)4]2- или октаэдрическим [Zn(H2O)6]2+. Кинетическая устойчивость комплексов во многом определяется электронной конфигурацией центрального атома и его симметрией. Окраска координационных соединений обусловлена переходами между энергетическими уровнями, определяемыми электронной конфигурацией центрального иона и симметрией координационного полиэдра. При этом поглощается часть видимого спектра в виде суперпозиции полос поглощения как результат перехода с нижнего уровня на вышележащие, а соединение приобретает окраску, дополнительную к цвету поглощаемых лучей (табл 9.2). Ионы [Sc(Lig)6]3+ и [Zn(Lig)6]2+ бесцветны, поскольку у первого нет электронов на dε-уровне, а у второго все d-орбитали заполнены. Окраска тетраэдрических тетраоксоанионов
) в тетраэдре. Октаэдрические комплексы Ni3+ получены только в примесных кристаллах, в которых Ni3+ занимает место Al3+. 3d8 (обычно Ni2+). В многочисленных октаэдрических комплексных ионах - [Ni(H2O)6]2+, [Ni(NH3)6]2+, [Ni(NO2)6]4- - Ni2+ сохраняет два неспаренных электрона. Если же образуются плоские четырехкоординационные (квадратные) комплексы типа [Ni(CN)4]2-, то они не содержат неспаренных электронов (S = 0) из-за того, что понижение симметрии от октаэдрической до квадратной приводит к расщеплению трехкратновырожденного уровня (dε, t2g) на дву- и однократный (синглетный), а двукратновырожденный уровень (dγ, eg) - на два синглета. В результате самый высокоэнергетический синглетный уровень оказывается незаселенным. 3d9 (Cu2+). Ионы Cu2+ образуют многочисленные координационные соединения с координационными числами шесть, пять и четыре: [Cu(H2O)6]2+, [CuCl5]3-, [Cu(NH3)4]2+ или [CuCl4]2-. Единственный неспаренный электрон сохраняется независимо от симметрии. Моногидрат ацетата меди (II) в кристаллическом состоянии изоструктурен моногидрату ацетата хрома (II) (рис. 9.8). В бис(?-диацетато-0'0'-аква) димеди (II) ионы меди (II) связаны слабой?-связью, результатом которой является молекулярный антиферромагнетизм, объясненный впервые при интерпретации необычных спектров электронного парамагнитного резонанса. 3d10 (Cu+, Zn2+). Ион Cu+ обычно является двухкоординационным [CuCl2]-, [Cu(NH3)2]+, а Zn2+ в зависимости от лигандов может быть тетраэдрическим [Zn(CN)4]2- или октаэдрическим [Zn(H2O)6]2+. Кинетическая устойчивость комплексов во многом определяется электронной конфигурацией центрального атома и его симметрией. Окраска координационных соединений обусловлена переходами между энергетическими уровнями, определяемыми электронной конфигурацией центрального иона и симметрией координационного полиэдра. При этом поглощается часть видимого спектра в виде суперпозиции полос поглощения как результат перехода с нижнего уровня на вышележащие, а соединение приобретает окраску, дополнительную к цвету поглощаемых лучей (табл 9.2). Ионы [Sc(Lig)6]3+ и [Zn(Lig)6]2+ бесцветны, поскольку у первого нет электронов на dε-уровне, а у второго все d-орбитали заполнены. Окраска тетраэдрических тетраоксоанионов  и
и  объясняется переходом электронов со связывающих, заполненных электронами оксо-лигандов, на несвязывающие dγ (dz⊃2;, dx²-y²) центрального атома. По мере увеличения заряда аниона разность между этими уровнями меняется и в
объясняется переходом электронов со связывающих, заполненных электронами оксо-лигандов, на несвязывающие dγ (dz⊃2;, dx²-y²) центрального атома. По мере увеличения заряда аниона разность между этими уровнями меняется и в  энергия перехода выходит из видимого диапазона.
энергия перехода выходит из видимого диапазона.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 491; Нарушение авторских прав?; Мы поможем в написании вашей работы!

 2
2
 3
3