КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Удельная и эквивалентная электропроводность
|
|
|
|
Электропроводность (удельная и эквивалентная), ее зависимость от концентрации и температуры. Подвижность ионов, закон Кольрауша, аномальная подвижность ионов водорода и гидроксила
Электропроводность К - величина, обратная электрическому сопротивлению R. Так как
R = r  , то К =
, то К =  ×
× 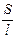 = k
= k 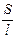 ,
,
где r - удельное электрическое сопротивление; l - расстояние между электродами; S - площадь электрода; k - удельная электропроводность.
Удельная электропроводность k жидкости - это электропроводность одного кубического сантиметра раствора, заполняющего пространство между плоскими электродами одинаковой, очень большой площади, находящимися на расстоянии 1 см. Кубический сантиметр раствора должен находиться вдали от границ электрода. [k] = Ом–1× см–1. Требования к электродам (плоские, параллельно расположенные) вытекают из необходимости создания однородного электрического поля.
Кривая зависимости удельной электропроводности растворов от концентрации обычно имеет максимум, четко выраженный для сильных электролитов и сглаженный для слабых (см. рис. 26). Наличие максимумов на кривых k - с можно объяснить следующим образом. Электропроводность растет пропорционально числу ионов, которое, в свою очередь, растет с концентрацией, но существуют и факторы противоположного действия. В концентрированных растворах сильных электролитов ионная атмосфера существенно уменьшает скорость движения ионов, и электропроводность падает. В слабых электролитах плотность ионной атмосферы мала и скорость движения ионов мало зависит от концентрации, однако с увеличением концентрации раствора заметно уменьшается степень диссоциации, что приводит к уменьшению концентрации ионов и падению электропроводности.
 k
Сильный электролит
Слабый электролит
с
Рис. 26. Зависимость удельной электропроводности от концентрации электролита k
Сильный электролит
Слабый электролит
с
Рис. 26. Зависимость удельной электропроводности от концентрации электролита
| l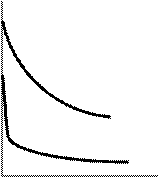 Сильный
электролит
Слабый
электролит
с
Рис. 27. Зависимость эквивалентной электропроводности от концентрации электролита
Сильный
электролит
Слабый
электролит
с
Рис. 27. Зависимость эквивалентной электропроводности от концентрации электролита
|
Удельная электропроводность зависит от температуры. Зависимость дается эмпирическим уравнением
kt = k18 × [1 + a (t – 18)],
где a - температурный коэффициент электропроводности (a > 0); k18 (k25) - стандартное значение. Коэффициент a зависит от природы электролита. В случае слабых электролитов a больше, чем для сильных. Следует отметить, что температурные коэффициенты электропроводности водных растворов и вязкости воды близки по своей величине, но обратны по знаку. Это свидетельствует о том, что увеличение удельной электропроводности с ростом температуры связано, главным образом, с уменьшением вязкости раствора.
Экспериментальное определение электропроводности растворов основано на измерении омического сопротивления ячейки с платиновыми электродами и исследуемым раствором путем пропускания переменного тока. Ток в этом случае проходит не только через поверхности электродов, обращенные друг к другу, но и через некоторую часть их тыльных сторон. Общее сопротивление ячейки зависит также от ее конструкции:
R = br l / S,
где b – коэффициент, зависящий от геометрических особенностей ячейки.
Для любой ячейки можно определить коэффициент k, который называется постоянной ячейки, и рассчитать удельную электропроводность по уравнению
k = k /Rэксп,
где Rэксп – измеренное сопротивление ячейки с раствором. Постоянную ячейки определяют по раствору, удельная электропроводность которого известна (обычно применяют раствор KCl).
Эквивалентная электропроводность l [в см2/(г-экв×Ом)] - это электропроводность такого объема (V см3) раствора, в котором содержится 1 г-экв растворенного вещества; раствор заполняет пространство между плоскими электродами одинаковой, очень большой площади, находящимися на расстоянии 1 см.
Найдем связь между k и l. Представим себе погруженные в раствор параллельные электроды на расстоянии 1 см, имеющие весьма большую площадь. Электропроводность раствора, заключенного между поверхностями таких электродов, имеющими площадь, равную V см2, и есть эквивалентная электропроводность раствора. Объем раствора между этими площадями электродов равен V см3 и содержит 1 г-экв соли. Величина V, равная 1000/с см3/г-экв, называется разведением. Таким образом,
l = k× V; l =  .
.
Мольная электропроводность электролита m - это произведение эквивалентной электропроводности на число грамм-эквивалентов в 1 моль диссоциирующего вещества.
Зависимость эквивалентной электропроводности от концентрации:
1. Зависимость l - с: с увеличением концентрации с величина l уменьшается сначала резко, а затем более плавно (см. рис. 27).
2. Зависимость l -  : для сильных электролитов в области малых концентраций соблюдается медленное линейное уменьшение l с увеличением
: для сильных электролитов в области малых концентраций соблюдается медленное линейное уменьшение l с увеличением  (см. рис. 28, а), что соответствует эмпирической формуле Кольрауша (закону квадратного корня): l = l¥ - А
(см. рис. 28, а), что соответствует эмпирической формуле Кольрауша (закону квадратного корня): l = l¥ - А ,
,
l¥ - предельная эквивалентная электропроводность при бесконечном разведении: с ® 0, V ® ¥. А – эмпирическая постоянная. При несколько более высоких концентрациях сильных электролитов лучшее согласие с опытом дает уравнение, известное под названием закона кубического корня:
l = l¥ - А .
.
Для разбавленных растворов слабых электролитов вышеприведенные законы не соблюдаются.
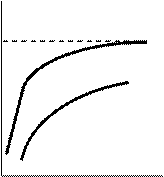
3. Зависимость l - V: значение l сильных электролитов растет с увеличением V и асимптотически приближается к l¥. Для слабых электролитов значение l также растет с увеличением V, но приближение к пределу и величину предела в большинстве случаев практически нельзя установить (см. рис. 28, б).
l Сильный электролит
Слабый электролит
|  l
l¥
Сильный
электролит
Слабый
электролит
V
l
l¥
Сильный
электролит
Слабый
электролит
V
| |||
| а | б | |||
| Рис. 28. Зависимость эквивалентной электропроводности от концентрации с (а) и разведения V (б) |
Все вышесказанное касалось электропроводности водных растворов. Для электролитов с другими растворителями рассмотренные закономерности сохраняются, но имеются и отступления от них, например, на кривых l - с часто наблюдается минимум (аномальная электропроводность).
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 774; Нарушение авторских прав?; Мы поможем в написании вашей работы!