
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Аллостерические ферменты
|
|
|
|
Регуляция активности ферментов
Различают экстенсивную и интенсивную регуляцию активности ферментов в клетках и тканях организма. Экстенсивная регуляция обусловлена индукцией или репрессией генов, кодирующих синтез соответствующих ферментов. Увеличение или уменьшение числа активных молекул определяет суммарную активность пула данного фермента в каком-либо компартменте клетки, в ткани или целом органе. В физиологических условиях содержание того или иного фермента в клетке постоянно и регулируется двумя процессами: скоростью его синтеза и распада. Оба эти процесса взаимосвязаны и контролируются на генном уровне. Увеличение скорости синтеза ферментативного белка обусловливает активацию внутриклеточных протеиназ и ускоренный распад «старых» молекул фермента, а снижение скорости синтеза приводит к замедлению распада ферментативного белка.
Интенсивная регуляция связана с изменением активности зрелых, функционирующих молекул и определяется разнообразными молекулярными механизмами.
|
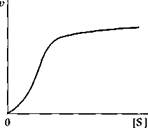
Кривая зависимости скорости ферментативной реакции от концентрации субстрата, характерная для аллостерических ферментов
Термин аллостерический образован от греческих слов: аллос — другой и стереос — пространственный. Существует ряд ферментов, имеющих в своем составе, кроме активного центра, так называемый аллостерический центр, присоединение к которому определенных химических веществ — эффекторов — приводит к изменению конформации белковой глобулы и, как следствие, модификации ферментативной активности. Молекулы аллостерических ферментов содержат наборы как активных, так и аллостерических центров, причем с аллостерическим центром может соединяться как субстрат, так и эффектор, отличающийся по строению от субстрата В первом случае взаимодействие является гомотроп-ным, во втором — гетеротропньш. Пространственная обособленность активных и аллостерических центров обусловлена наличием четвертичной структуры, характерной для аллостерических ферментов. Аллостерические взаимодействия наиболее ярко проявляются в характере кривых зависимости скорости ферментативной реакции от концентрации субстрата. Вместо гиперболической кривой, подчиняющейся закономерностям Михаэлиса—Ментен, для аллостерических ферментов характерна сигмоидная кривая, представленная на рис. 6.13. Как видно из рисунка, при малых концентрациях субстрата скорость ферментативной реакции гораздо ниже, чем для обычных ферментов в равных условиях.
Присоединение лиганда к аллостерическому центру фермента изменяет скорость реакции, причем если скорость реакции возрастает, то такой эффектор называют положительным, если снижается — отрицательным.
Аллостерические ферменты состоят как минимум из двух идентичных субъединиц, каждая из которых имеет один активный и один регуляторный (аллостерический) центры. При взаимодействии субстрата или эффектора с ферментом происходит изменение конформации одной из субъединиц, что вызывает модификацию высших структур второй субъединицы. Конформаци-онные превращения обусловливают изменения каталитической активности молекулы фермента.
Механизм действия аллостерических ферментов имеет много общего с процессом присоединения кислорода к гемоглобину (гл. 3).
В обоих случаях присоединение лиганда приводит к изменению конформации белковых субъединиц и изменению скорости реакции.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2309; Нарушение авторских прав?; Мы поможем в написании вашей работы!