
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Адиабатный процесс. Процесс, протекающий без подвода и отвода теплоты, т.е
|
|
|
|
Процесс, протекающий без подвода и отвода теплоты, т.е. при отсутствии теплообмена рабочего тела с окружающей средой, называется адиабатным, следовательно, dq = 0 Þ q = 0.
Выведем уравнение адиабаты. Из уравнения первого закона термодинамики при dq = 0 имеем:
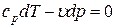 или
или 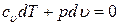 .
.
Разделив первое уравнение на второе, получим:
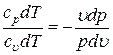 Þ
Þ 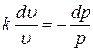 ,
,
где 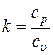 - показатель адиабаты, который определяется числом степеней свободы молекулы. Для одноатомного газа k = 1,66, для двухатомного k = 1,44, для трех- и многоатомных k = 1,33.
- показатель адиабаты, который определяется числом степеней свободы молекулы. Для одноатомного газа k = 1,66, для двухатомного k = 1,44, для трех- и многоатомных k = 1,33.
Интегрируя последнее уравнение при условии, что k = const, находим:
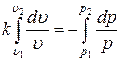 Þ
Þ 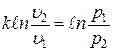 .
.
После потенцирования имеем:
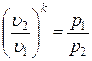 Þ
Þ 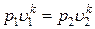 .
.
Следовательно, уравнение адиабаты при постоянном отношении теплоемкостей имеет вид:
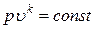 .
.
Для показателя адиабаты справедливо также следующее выражение:
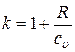 ,
,
так как 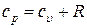 - уравнение Майера.
- уравнение Майера.
Рассмотрим зависимость между основными параметрами в адиабатном процессе. Из уравнения адиабаты следует, что
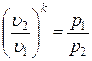 Þ
Þ 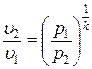 .
.
Если это соотношение параметров тела подставить в уравнение состояния для крайних точек процесса:
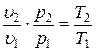 ,
,
то после соответствующих преобразований найдем:
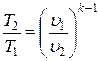 ;
; 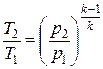 .
.
Поскольку k > 1, то в координатах р, u линия адиабаты идет круче линии изотермы: при адиабатном расширении давление понижается быстрее, чем при изотермическом, так как в процессе расширения уменьшается температура газа.
Графики процесса в рu и Ts – диаграммах представлены на рис 4.2.
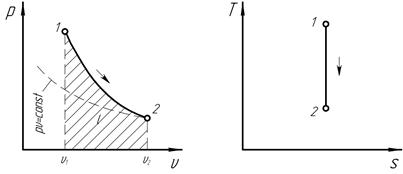
Рис. 4.2. Графики термодинамического процесса при s = const.
Работа расширения при адиабатном процессе согласно первому закону термодинамики совершается за счет уменьшения внутренней энергии и может быть вычислена по одной из следующих формул:
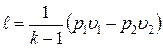 ; ;
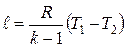
| 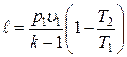
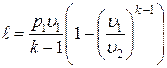 ; ;
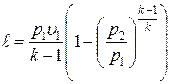 ; ;
|
Изменение внутренней энергии:
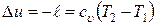 .
.
 Поскольку при адиабатном процессе dq = 0, энтропия рабочего тела не изменяется (ds = 0 и s = const). Следовательно, адиабатный процесс является одновременно изоэнтропным и изображается в T, s – диаграмме вертикальной прямой (рис. 4.2).
Поскольку при адиабатном процессе dq = 0, энтропия рабочего тела не изменяется (ds = 0 и s = const). Следовательно, адиабатный процесс является одновременно изоэнтропным и изображается в T, s – диаграмме вертикальной прямой (рис. 4.2).
Схема распределения энергии в адиабатном процессе представлена на рис. 4.3.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 733; Нарушение авторских прав?; Мы поможем в написании вашей работы!