
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Исследование политропных процессов
|
|
|
|
Каждому политропному процессу отвечает свой собственный закон распределения энергии и свое собственное значение n, т. е. величина n и закон распределения энергии в политропном процессе взаимосвязаны. Отсюда и возникает возможность по величине n судить о характере распределения энергии в процессе. Наметим три характерные группы политроп:
1. показатель политропы изменяется в пределах 1 < n < k;
2. показатель политропы изменяется в пределах -¥ < n < 1;
3. показатель политропы изменяется в пределах +¥ > n > k.
Покажем, что у каждой из намеченных групп политроп имеется свой собственный закон распределения энергии, который можно легко определить в результате следующего анализа.
Рассмотрим вначале расположение всевозможных политропных процессов по отношению к адиабатному процессу (рис. 4.4).
 В рu - координатах все политропные процессы расположены или выше или ниже адиабаты. Если зафиксировать для всех политроп расширения некоторой объем, то из элементарных рассуждений следует, что если в данном процессе (n > k) при объеме u давление упало по отношению к адиабатному, в котором внешнее тепло не участвует (q = 0), то это может быть только за счет дополнительного отвода тепла (q < 0) в этом процессе. Наоборот, если при расширении к моменту наступления объема u, давление в политропном процессе (n < k) повысилось по отношению к адиабатному (q = 0), то это может произойти только за счет подвода тепла в этом процессе (q > 0). К аналогичным результатам можно прийти, если рассмотреть соответствующие политропы сжатия.
В рu - координатах все политропные процессы расположены или выше или ниже адиабаты. Если зафиксировать для всех политроп расширения некоторой объем, то из элементарных рассуждений следует, что если в данном процессе (n > k) при объеме u давление упало по отношению к адиабатному, в котором внешнее тепло не участвует (q = 0), то это может быть только за счет дополнительного отвода тепла (q < 0) в этом процессе. Наоборот, если при расширении к моменту наступления объема u, давление в политропном процессе (n < k) повысилось по отношению к адиабатному (q = 0), то это может произойти только за счет подвода тепла в этом процессе (q > 0). К аналогичным результатам можно прийти, если рассмотреть соответствующие политропы сжатия.
Следовательно, адиабата разделяет всевозможные политропы на две группы: первая группа политроп в рu - координатах, расположенных выше адиабаты, идет с подводом тепла (+ q), вторая группа политроп, расположенных ниже адиабаты, идет с отводом тепла (- q), независимо от того, идут ли процессы сжатия или расширения. В Тs - координатах, процессы, расположенные вправо от адиабаты (с увеличением энтропии), идут с подводом тепла, влево от адиабаты (с уменьшением энтропии) идут с отводом тепла.
 Рассмотрим расположение всевозможных политроп по отношению к изотерме (рис. 4.5).
Рассмотрим расположение всевозможных политроп по отношению к изотерме (рис. 4.5).
Если опять зафиксировать в ходе процессов расширения какой-то объем υ, то, сопоставляя политропные процессы с изотермическими (n =1, T =const), можно сделать следующие выводы. Если в политропическом процессе расширения к моменту наступления υ давление оказалось выше, чем в изотермическом, это может произойти только в результате повышения температуры газа, т. к. в изотермическом процессе расширения теплота сообщается газу, но Т = const. Так как температура в этих процессах увеличивается, то и внутренняя энергия в этих процессах возрастает. Наоборот, если давление в политропном процессе лежит ниже значения давлений изотермического процесса, то это означает, что эти процессы расширения сопровождаются понижением температуры и уменьшением внутренней энергии газа. Аналогичные результаты получаются, если рассмотреть соответствующие политропы сжатия.
Итак, изотерма в pυ - и Ts - координатах делит всевозможные политропы на две группы:
- первая группа политроп, лежащая выше изотермы, идет с увеличением u (∆ u > 0) и ростом Т (∆ T > 0).
- вторая группа политроп, лежащая ниже изотермы, идет с уменьшением u (∆ u < 0) и понижением Т (∆ T < 0),.
Это правило справедливо для всех процессов как сжатия, так и расширения.
Воспользовавшись данной системой анализа, определим закон распределения энергии в каждой из намеченных групп.

Рис. 4.6. Политропные процессы
Первая группа политропных процессов.
К этой группе относятся процессы (рис. 4.6) у которых 1 < n < k, графики этих процессов располагаются между изотермой и адиабатой. Процессы этой группы в случае расширения газа осуществляются с подводом тепла (процессы расположены выше адиабаты) и с уменьшением внутренней энергии газа (процессы расположены ниже изотермы), т. е. согласно схеме, представленной на рис. 4.7.
 Коэффициент распределения теплоты ψ у этой группы процессов будет отрицательным. Это свидетельствует о том, что тепло q и изменение внутренней энергии ∆u в этих процессах имеют разные знаки.
Коэффициент распределения теплоты ψ у этой группы процессов будет отрицательным. Это свидетельствует о том, что тепло q и изменение внутренней энергии ∆u в этих процессах имеют разные знаки.
При увеличении показателя n этой группы процессов закон распределения энергии остается постоянным, но усиливается роль в процессе внутренней энергии и уменьшается роль теплоты.
Теплоемкость газа в политропных процессах этой группы, вычисляемая по формуле:
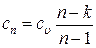
будет величиной отрицательной. Физически это означает, что в этих процессах, несмотря на сообщение газу теплоты, его внутренняя энергия, а с ней температура уменьшаются.
Вторая группа политропных процессов.
К этой группе относятся процессы, у которых -∞ < n < 1 (рис. 4.6). Графики политропных процессов второй группы располагаются между изохорой и изотермой. В процессах этой группы расширение газа осуществляется с подводом теплоты (процессы расположены выше адиабаты) и увеличением внутренней энергии газа (процессы расположены над изотермой), т.е. согласно схеме, представленной на рис.4.8.
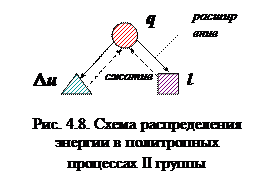 Часть теплоты, идущей на увеличение внутренней энергии газа (ψ) величина положительная. С увеличением n у процессов этой группы закон распределения энергии сохраняется, но при этом уменьшается доля теплоты, идущей на увеличение ∆u, и увеличивается доля теплоты, идущей на l. Теплоемкость газа в процессах этой группы будет величиной положительной.
Часть теплоты, идущей на увеличение внутренней энергии газа (ψ) величина положительная. С увеличением n у процессов этой группы закон распределения энергии сохраняется, но при этом уменьшается доля теплоты, идущей на увеличение ∆u, и увеличивается доля теплоты, идущей на l. Теплоемкость газа в процессах этой группы будет величиной положительной.
Третья группа политропных процессов.
К этой группе принадлежат процессы, в которых +∞ > n > k графики этих процессов лежат между адиабатой и изохорой.
Процессы этой группы в случае расширения газа осуществляются с уменьшением внутренней энергии (процессы расположены ниже изотермы) и отдачей теплоты в холодильник (процессы расположены ниже адиабаты), т.е. согласно схеме, представленной на рис. 4.9.
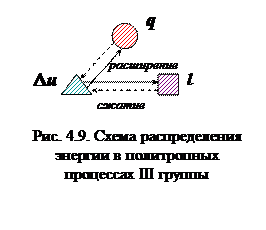 С увеличением показателя n этой группы процессов закон распределения энергии сохраняется, но увеличивается доля теплоты (за счет уменьшения внутренней энергии), отдаваемая в холодильник, и уменьшается доля теплоты, идущая на работу.
С увеличением показателя n этой группы процессов закон распределения энергии сохраняется, но увеличивается доля теплоты (за счет уменьшения внутренней энергии), отдаваемая в холодильник, и уменьшается доля теплоты, идущая на работу.
Теплоемкость газа этой группы процессов будет величиной положительной. Коэффициент распределения теплоты ψ у этой группы процессов величина положительная.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2443; Нарушение авторских прав?; Мы поможем в написании вашей работы!