
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Внутренние
|
|
|
|
Опр.3.1.14. Внутренними (интенсивными) параметрами состояния называются параметры, зависящие как от обобщенных координат внешних тел, так и от усредненных значений координат и скоростей частиц, образующих систему.
Примеры внутреннего параметра
· плотность системы.
· энергия системы.
· давление.
Опр. 3.1.15. Давлением называется физическая величина р, равная пределу отношения численного значения 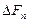 нормальной силы, действующей на участок поверхности тела площадью
нормальной силы, действующей на участок поверхности тела площадью 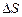 , к величине
, к величине 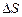 при
при 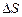 , стремящейся к нулю:
, стремящейся к нулю: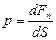 (3.1.1.)
(3.1.1.)
В простом случае давление определяется как отношение нормальной силы к площади поверхности, на которую она действует: 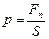 .
.
Опр.3.1.17. Грамм-молекулой или молем (килограмм-молекулой или киломолем) называется такое количество химически однородного вещества, масса которого, выраженная в граммах, численно равна его молекулярному весу: 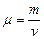 . (3.1.2.)
. (3.1.2.)
Масса киломоля смеси газов определяется по формуле 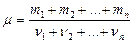 . (3.1.2’.)
. (3.1.2’.)
где 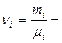 число киломолей
число киломолей 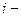 го газа, находящегося в смеси,
го газа, находящегося в смеси, 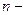 число различных газов в смеси.
число различных газов в смеси.
Опр.3.1.18. Объем 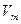 одного моля вещества называется его молярным объемом:
одного моля вещества называется его молярным объемом: 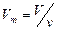 . (3.1.3.)
. (3.1.3.)
Опр.3.1.19. Грамм-атомом (килограмм-атомом) называется такое количество химически простого вещества (элемента), масса которого, выраженная в граммах (килограммах), равна его атомному весу.
Число молекул в грамм-молекуле и число атомов в грамм-атоме для всех веществ одинаковы. Это число называется числом Авогадро NA: NA = 6,023 · 1023 моль -1 = 6,023 · 1026 кмоль -1. (3.1.4.)
Если  масса одной молекулы, то масса произвольного количества вещества
масса одной молекулы, то масса произвольного количества вещества 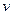 равна:
равна: 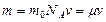 (3.1.5.)
(3.1.5.)
где 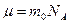 - молярная масса газа, равная отношению массы газа к содержащемуся в нем количеству вещества
- молярная масса газа, равная отношению массы газа к содержащемуся в нем количеству вещества 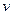 :
: 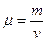 . (3.1.6.)
. (3.1.6.)
Число молекул в данной массе вещества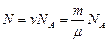 . (3.1.7.)
. (3.1.7.)
Опр.3.1.20. Температурой называется физическая величина, характеризующая степень нагретости тела. Температура - мера интенсивности теплового движения атомов, молекул и других частиц, образующих систему.
Понятие температуры имеет смысл только для равновесных состояний системы и не имеет смысла для одной частицы.
В состоянии термодинамического равновесия системы температуры всех тел, образующих систему, одинаковы. Измерение температуры можно производить только косвенным путем, основываясь на зависимости от температуры таких физических свойств тел, которые поддаются непосредственному измерению. Применяемые для этого тела (вещества) называются термометрическими, а устанавливаемая с их помощью шкала температуры - эмпирической.
Основной недостаток эмпирических шкал температуры состоит в их зависимости от специфических особенностей конкретных термометрических веществ. В качестве исходных значений, служащих при построении шкалы температуры для установления начала отсчета температуры и единицы ее измерения - градуса, применяются температуры перехода химически чистых веществ из одного агрегатного состояния в другое, например температуры плавления льда (t0) и кипения воды (tк) при нормальном атмосферном давлении, равном 760 мм рт. ст. Величины t0 и tк в зависимости от типа шкалы имеют следующие значения:
а) Шкала Цельсия (стоградусная шкала): t0 = 0°С, tк = 100°С.
б) Шкала Фаренгейта: t0 = 32°F, tк = 212°F.
Связь между температурами, выраженными в градусах Цельсия и Фаренгейта, имеет вид: 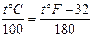
в) Шкала Кельвина: температура T отсчитывается от абсолютного нуля (t°С =- 273,15°С) и называется абсолютной температурой. Связь между значениями температуры по шкале Кельвина (T °К) и шкале Цельсия (t °C) имеет вид: 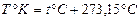
Внутренние параметры термодинамической системы, находящейся в равновесном состоянии, зависят только от ее внешних параметров и от температуры: yk = f (x1, x2,... xn, T) (3.1.8.)
где yk - внутренний параметр, a x1, x2,... xn - внешние параметры.
Например, равновесное состояние физически однородной термодинамической системы в соответствии с правилом фаз Гиббса полностью определяется двумя параметрами. Поэтому равновесное давление в этой системе является функцией ее объема и температуры (масса системы предполагается фиксированной):p=f1(V,Т). (3.1.9.)
Если в уравнении (3.1.3.) yk представляет собой обобщенную силу, сопряженную какому-либо из внешних параметров x1, x2,... xn, то уравнение (3.1.4.) называется термическим уравнением состояния системы (уравнением состояния системы). Например, уравнение (3.1.4.) является термическим уравнением состояния физически однородной системы.
Уравнение (3.1.3.), записанное для внутренней энергии U системы:
U = f2 (x1, x2,... xn, T) называется калорическим уравнением состояния системы.
В термодинамике уравнения состояния исследуемой системы предполагаются известными из опыта. Теоретический вывод этих уравнений может быть осуществлен методами статистической физики.
Опр.3.1.21. Термодинамическим процессом называется всякое изменение состояния термодинамической системы.
Опр.3.1.22. Равновесным (квазистатистическим) процессом называется термодинамический процесс, при котором система проходит непрерывный ряд равновесных состояний.
Опр.3.1.23. Круговым процессом или циклом называется термодинамический процесс, в результате совершения которого система возвращается в исходное состояние.
Опр.3.1.24. Изопроцессами называются термодинамические процессы, протекающие при неизменном значении какого-либо параметра состояния.
1. Изохорным (изохорическим) процессом называется термодинамический процесс, протекающий при постоянном объеме системы.
2. Изобарным (изобарическим) процессом называется термодинамический процесс, протекающий при постоянном давлении.
3. Изотермическим (изотермным) процессом называется термодинамический процесс, протекающий при постоянной температуре.
4. Адиабатным (адиабатическим) процессом называется термодинамический процесс, осуществляемый системой без теплообмена с внешними телами.
Опр.3.1.25. Функцией состояния называется такая физическая характеристика системы, изменение которой при переходе системы из одного состояния в другое не зависит от вида соответствующего этому переходу термодинамического процесса, а целиком определяется значениями параметров начального и конечного состояний. Важнейшими функциями состояний являются внутренняя энергия U, энтальпия H, энтропия S, изохорно-изотермный потенциал F и изобарно-изотермный потенциал.
Опр.3.1.26. Экстенсивными величинами называются функции состояния термодинамической системы, зависящие от ее массы.
Таковы, например, перечисленные выше функции. В уравнениях термодинамики часто используют значения экстенсивных величин, отнесенные либо к единице массы системы, либо к одному молю.
Опр.3.1.27. Интенсивными величинами называются функции состояния термодинамической системы, не зависящие от ее массы.
Таковы, например, температура, плотность, вязкость, диэлектрическая проницаемость и т. д.
Равновесные состояния физически однородной системы и совершаемые ею равновесные процессы можно изображать графически соответственно точками и кривыми на плоскости с прямоугольными декартовыми координатами, вдоль осей которых откладываются параметры состояния системы или однозначно связанные с ними функции состояния. Такое графическое изображение называется термодинамической диаграммой. Наиболее распространенными являются диаграммы V - р, s - Т, s - H и др. (первый символ указывает величину, откладываемую по оси абсцисс, второй - по оси ординат).
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 243; Нарушение авторских прав?; Мы поможем в написании вашей работы!