
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Анализ природных и сточных вод
|
|
|
|
Определение рН воды
Величина рН в воде водоемов хозяйственно-питьевого водопользования регламентируется в пределах 6,5 - 8,5. В большинстве природных вод рН составляет от 6,5 до 8,5 и зависит от соотношения концентраций свободного оксида углерода (IV) и HCO3-. Более низкие значения рН могут наблюдаться в кислых болотных водах за счет повышенного содержания гуминовых и фульвокислот. Летом при интенсивном фотосинтезе рН может повышаться до 9. На величину рН влияет содержание карбонатов, гидроокисей, солей, подверженных гидролизу, гуминовых веществ и др.
В результате происходящих в воде химических и биологических процессов и потерь углекислоты рН воды может быстро меняться, поэтому рН следует измерять сразу же.
Для ориентировочного определения рН можно пользоваться универсальным бумажным индикатором.
Потенциометрический метод определения рН отличается большой точностью (0,02). Определению не мешают окраска, мутность, свободный хлор, окислители, восстановители, повышенное содержание солей.
Ход анализа.
После проверки потенциометра ополосните дистиллированной водой стаканчик и электроды. Налейте в стаканчик анализируемую воду и измеряйте рН 2 – 3 раза с интервалом 2 – 3 мин. Последние два показания прибора должны быть одинаковыми. Если исследуемая вода имеет низкую температуру (около 00С), то она должна быть нагрета до комнатной температуры.
Определение цветности воды
Цветность природных вод обусловлена главным образом присутствием гуминовых веществ и комплексных соединений железа (III). Количество этих веществ зависит от геологических условий, водоносных горизонтов, характера почв, наличия болот и торфяников в бассейне реки и т.д.
Цветность воды определяют визуально. Результаты выражают в градусах цветности. Цветность от 0 до 500 выражается с точностью до 20, от 51 до 1000 – до 50, от 101 до 2500 – до 100, от 251 до 5000 до 200.. При цветности выше 800 воду необходимо разбавлять.
Ход анализа
Приготовление стандартных растворов
Раствор 1: 0,0875 г K2Cr2O7, 2 г CoSO4×7H2O и 1 мл серной кислоты (пл. 1,84 г/см3) растворите в дистиллированной воде в мерной колбе на 1 л, доведите объем раствора до метки дистиллированной водой. Этот раствора соответствует цветности 5000.
Раствор 2: 1 мл серной кислоты (пл. 1,84 г/см3) растворите в дистиллированной воде в мерной колбе на 1 л, доведите объем раствора до метки дистиллированной водой.
Подготовка шкалы стандартных растворов. Смешивая растворы 1 и 2 в соотношениях, указанных в таблице, приготовьте шкалу цветности.
| Раст-вор | Градусы цветности | |||||||||||||
| N1,мл N2,мл |
В цилиндр, однотипный с теми, в которых приготовлена шкала, налейте 100 мл исследуемой воды. Просматривая сверху на белом фоне, подберите раствор шкалы с тождественной окраской.
Определение запаха воды
Запах воды водоемов не должен превышать 2 баллов, обнаруживаемых непосредственно в воде. Определение основано на органолептическом исследовании характера и интенсивности запаха воды при 200 и 600С.
Запах воды обусловлен наличием в ней летучих и пахнущих веществ, которые попадают в неё естественным путем или сточными водами. По характеру запахи делятся на две группы.
Запахи естественного происхождения описываются по следующей терминологии.
| Символ | Характер запаха | Примерный род запаха |
| А | Ароматический | Огуречный, цветочный |
| Б | Болотный | Илистый, тинистый |
| Г | Древесный | Запах мокрой щепы, древесный |
| З | Землистый | Прелый, свежевспаханной земли |
| Р | Рыбный | Рыбы, рыбьего жира |
| С | Сероводород | Тухлых яиц |
| Т | Травянистый | Сена, скошенной травы |
| Н | Неопределенный | Не подходящий под предыдущие определения |
Чистые природные воды запахов не имеют.
Запахи искусственного происхождения (от промышленных выбросов, для питьевой воды – от обработки воды реагентами на водопроводных сооружениях и т.п.) называют по соответствующим веществам: хлорфенольный, камфорный, бензиновый, хлорный и т.п.
Интенсивность запаха оценивают по пятибалльной системе, приведенной в таблице.
| Балл | Интенсивность запаха | Описание определения |
| Никакого | Отсутствие ощутимого запаха. | |
| Очень слабый | Запах, обнаруживаемый опытным исследователем. | |
| Слабый | Запах, не привлекающий внимания, но такой, который можно заметить, если указать на него. | |
| Отчетливый | Запах, обращающий на себя внимание и делающий воду непригодной для питья. | |
| Заметный | Запах, легко обнаруживаемый и могущий дать повод относиться к воде с неодобрением. | |
| Очень сильный | Запах настолько сильный, что делает воду непригодной для питья |
Водой, не имеющей запаха, считается такая, запах которой не превышает 2 балла.
Ход анализа
100 мл исследуемой воды при 200С налейте в колбу вместимостью 150 – 200 мл с широким горлом, накройте часовым стеклом или притертой пробкой, встряхните вращательным движением, откройте пробку или сдвиньте часовое стекло и быстро определите характер и интенсивность запаха. Затем колбу нагрейте до 600С на водяной бане и также оцените запах.
Определение прозрачности воды
Прозрачность воды обусловлена ее цветом и мутностью, т.е. содержанием в ней различных окрашенных и взвешенных органических и минеральных веществ. Мерой прозрачности служит высота столба воды, при котором можно различать на белой бумаге стандартный шрифт определенного размера и типа. Прозрачность по шрифту выражают в см и определяют с точностью 0,5 см. Стандартный шрифт имеет высоту букв 3,5 мм.
Ход анализа
В цилиндр с внутренним диаметром 2,5 см и высотой 30 см налейте исследуемую воду и поместите его неподвижно над шрифтом на высоте 4 см. Сливая и доливая исследуемую воду, найдите высоту столба, еще позволяющую читать шрифт. Исследование проводите в хорошо освещенном помещении, но не на прямом свету, на расстоянии 1 м от окна. Измерение повторите 2 – 3 раза.
Определение перманганатной окисляемости
Окисляемость – общее количество содержащихся в воде восстановителей (неорганических и органических), реагирующих с сильными окислителями, например, бихроматом или перманганатом калия. Результаты определения окисляемости выражают в миллиграммах кислорода на 1 л воды (мг О/л).
Все методы определения окисляемости условны, а полученные результаты сравнимы только в том случае, когда точно соблюдены все условия анализа.
Наиболее полное окисление достигается бихроматом калия, поэтому бихроматную окисляемость нередко называют «химическим потреблением кислорода» (ХПК). Большинство соединений окисляется при этом на 95 – 100%. Нормативы ХПК воды водоемов хозяйственно-питьевого назначения – 15 мг О/л, культурно – бытового – 30 мг О/л.
Метод перманганатометрической окисляемости основан на окислении веществ, присутствующих в воде, 0,01 н. раствором KMnO4 в сернокислой среде при кипячении. Без разбавления можно определять окисляемость до 10 мг кислорода в 1 л.
При определении перманганатной окисляемости после реакции должно остаться не менее 40% введенного перманганата калия, так как степень окисления зависит от его концентрации. При большом расходе реагента пробу необходимо разбавлять.
Ход анализа
В колбу поместите 100 мл исследуемой воды (или разбавленной до 100 мл), несколько капилляров или кусочков пемзы, прилейте 5 мл разбавленной серной кислоты (1:3) и 10 мл 0,01 н. раствора KMnO4. Смесь нагревайте так, чтобы она закипела не ранее, чем через 5 мин, и кипятите точно 10 мин, закрыв колбу маленькой конической воронкой для уменьшения испарения. К горячему раствору прибавьте 10 мл 0,01 н. раствора щавелевой кислоты. Обесцвеченную горячую (80-900С) смесь титруйте 0,01 н. раствором KMnO4 до слабо розового окрашивания.
Если в процессе кипячения содержимое колбы потеряет розовую окраску или побуреет, то определение необходимо повторить, разбавив исследуемую воду. Определение также необходимо повторить, если при обратном титровании щавелевой кислоты израсходовано более 7 мл или менее 2 мл 0,01 н. раствора KMnO4.
Одновременно проведите холостой опыт со 100 мл дистиллированной воды, обрабатывая ее так же, как и анализируемую воду. Расход перманганата калия не должен превышать 0,3 мл.
Расчетные формулы
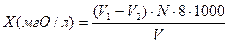 ;
;
где Х – перманганатная окисляемость, мг О/л;
V1 – объем перманганата калия, пошедший на титрование исследуемой воды, мл;
V2 – объем перманганата калия, пошедший на титрование холостой пробы воды, мл;
N – нормальность раствора перманганата калия;
8 – эквивалент кислорода;
V – объем пробы, взятой для анализа, мл.
Определение биологического потребления кислорода (БПК)
БПК - количество кислорода (мг), требуемое для окисления находящихся в 1 л воды органических веществ в аэробных условиях при 200С в результате протекающих в воде биохимических процессов за определенный период времени (БПК за 3, 5, 10, 20 т.д. суток).
Установлено, что при загрязнении водоемов преимущественно хозяйственно-бытовыми сточными водами с относительно постоянным составом и свойствами БПК5 (5-суточное) составляет 70% БПК полного.
Нормативы БПК воды водоемов хозяйственно-питьевого назначения – 3 мг/л кислорода, культурно – бытового – 6 мг/л кислорода.
Среди различных методов определения БПК наиболее распространено определение по разности содержания кислорода до и после инкубации при стандартных условиях (при 200С в аэробных условиях без дополнительного доступа воздуха и света).
БПК определяют в натуральной, тщательно перемешанной воде.
Ход анализа
Проба для анализа БПК должна быть обработана в день отбора (или при условии хранения пробы в холодильнике на следующий день). Для отбора проб воды необходимо использовать посуду с притертыми пробками и следить, чтобы при отборе проб воды она переливалась через край склянок.
РН воды при определении БПК должна быть в пределах 6,5 – 8,5. Температура исследуемой воды должна быть 200С. Для аэрации воды необходимо перед анализом встряхивать воду в колбе, заполненной водой на ¾ объема, в течение 1 мин. и затем быстро перенести воду в специальные колбы с притертыми крышками, заполняя колбы до самых краев.
Для фиксации кислорода введите в 8 колб емкостью 100 мл с анализируемой водой по 1 мл хлорида или сульфата марганца (400 г MnSO4×2H2O или 425 г MnCl2×2H2O растворите в 1 л дистиллированной воды) и по 1 мл щелочного раствора йодида калия (150 г KI растворите в 100 мл дистиллированной воды, 500 г NaOH растворите в 500 мл свежеприготовленной дистиллированной воды, оба раствора смешайте и доведите общий объем в мерной колбе до 1л). Пипетки на 1 мл следует погружать до дна колбы, часть жидкости при этом будет выливаться. После введения реактивов закройте склянки пробками, перемешайте резким перевертыванием. В таком виде оставьте склянки соответственно две на 3, две на 5 и две на 10 сут. Содержимое двух склянок проанализируйте сразу же.
Перед титрованием (осадок должен хорошо осесть) прибавьте в каждую склянку по 5 мл соляной кислоты (2:1), при этом часть жидкости будет переливаться через край. Каждую склянку закройте пробкой и содержимое её перемешайте, осадок гидроксида марганца при этом растворится и окислит йодистые соединения, а выделившийся йод окрасит раствор в желтый цвет. После перемешивания каждую пробу перенесите в колбу для титрования на 250 – 300 мл и быстро титруйте 0,02 н. раствором тиосульфата натрия в присутствии индикатора крахмала до исчезновения окраски.
Расчетные формулы
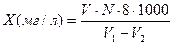 ;
;
где Х – содержание растворенного кислорода, мг/л;
V – объем тиосульфата натрия, пошедший на титрование исследуемой воды, мл;
V1 – объем кислородной склянки, мл;
V2 – объем всех реактивов, внесенных в воду для фиксации кислорода, мл;
N – нормальность раствора тиосульфата натрия;
8 – эквивалент кислорода.;
БПК = Х1 – Х2
где Х1 – содержание растворенного кислорода в пробе до начала инкубации (нулевой день);
Х2 – содержание растворенного кислорода в пробе после инкубации.
Определение щелочности или кислотности воды
После определения рН воды можно приступить к определению щелочности (если рН>7) или кислотности (если рН<7).
Под щелочностью воды понимают способность некоторых компонентов, содержащихся в воде, связывать эквивалентное количество сильной кислоты. Щелочность создают все катионы, которые в воде были уравновешены OH-, анионами слабых кислот (например, карбонаты и гидрокарбонаты). Щелочность определяется количеством сильной кислоты, необходимой для замещения этих анионов. Расход кислоты эквивалентен их общему содержанию и выражает общую щелочность воды. Щелочность выражают в мг-экв/л.
В обычных природных водах щелочность зависит в основном от присутствия гидрокарбонатов щелочноземельных металлов, в меньшей степени щелочных. В этом случае значение рН воды не превышает 8,3. Растворимые карбонаты и гидроксиды повышают значение рН.
Ход анализа
Отберите 100 мл исследуемой воды, добавьте 2-3 капли индикатора метилоранжа и титруйте 0,1 н раствором соляной кислоты в присутствии контрольного раствора до перехода окраски из желтой в оранжевую.
Расчетные формулы
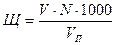 ;
;
где Щ – щелочность воды, мг-экв/л;
V – объем соляной кислоты, пошедший на титрование исследуемой воды, мл;
VП – объем пробы, взятый для анализа, мл;
N – нормальность раствора соляной кислоты;
Кислотностью называется содержание в воде веществ, вступающих в реакцию с гидроксил - ионами. Расход щелочи, пошедшей на реакцию, выражает общую кислотность воды. В обычных природных водах кислотность в большинстве случаев зависит только от содержания свободного CO2. Естественную часть кислотности создают также гуминовые и другие слабые органические кислоты. В этих случаях рН воды не бывает ниже 4,5. Кислотность выражают в мг-экв/л.
Ход анализа
Отберите 100 мл исследуемой воды, добавьте 2-3 капли индикатора фенолфталеина и титруйте 0,1 н раствором гидроксида натрия до появления розовой окраски, не исчезающей в течение 30 секунд.
Расчетные формулы
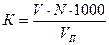 ;
;
где К – кислотность воды, мг-экв/л;
V – объем гидроксида натрия, пошедший на титрование исследуемой воды, мл;
VП – объем пробы, взятый для анализа, мл;
N – нормальность раствора гидроксида натрия.
Определение жесткости воды
Определение карбонатной жесткости воды
Жесткость воды изучают, чтобы выяснить её пригодность для растениеводства, животноводства, а также для технических целей. Под жесткостью понимают суммарное содержание в воде солей кальция и магния. Общую жесткость определяют комплексонометрическим методом, а карбонатную или временную жесткость – методом нейтрализации. Карбонатная жесткость зависит от содержания в воде гидрокарбонатов кальция и магния. Она почти полностью устраняется кипячением, при котором гидрокарбонаты разлагаются:
Ca(HCO3)2 = CaCO3¯ + CO2 + H2O.
Поэтому карбонатную жесткость называют также устранимой, или временной. Карбонатная жесткость отвечает той части катионов кальция и магния, которая эквивалентна содержащимся в воде анионам гидрокарбонатов этих металлов. Жесткость принято выражать в ммоль экв/л.
Ход анализа
Поместите 100 мл исследуемой воды в коническую колбу. Прибавьте 2-3 капли индикатора метилоранжа, перемешайте и титруйте раствором HCl до перехода желтой окраски индикатора в оранжевую. Титрование повторите не менее трех раз, до получения хорошо сходимых результатов.
Результаты рассчитайте в ммоль экв/л.
Определение общей жесткости воды
Под общей жесткостью понимают суммарное содержание ионов кальция и магния в воде, выраженное в ммоль экв/л. Она складывается из карбонатной (временной) и некарбонатной (постоянной) жесткости воды. Некарбонатная жесткость обусловлена наличием в воде сульфатов, хлоридов, силикатов, нитратов и фосфатов этих металлов.
Жесткость воды колеблется в широких пределах: от 0,1-0,2 ммоль экв/л в реках и озерах, расположенных в зонах тайги и тундры, до 80 ммоль экв/л и более - в подземных водах, морях и океанах. Различают воду мягкую (общая жесткость до 2 ммоль экв/л), средней жесткости (2-10 ммоль экв/л) и жесткую (более 10 ммоль экв/л). В поверхностных водоисточниках преобладает, как правило, карбонатная жесткость (70-80% от общей). Наибольшего значения жесткость воды достигает в конце зимы, а наименьшего – в период паводка. Так, в реке Волге (г. Нижний Новгород) максимальная жесткость бывает в марте (4,3 ммоль экв/л), а минимальная - в мае (0,5 ммоль экв/л). В подземных водах жесткость воды наиболее постоянна и меньше изменяется в течение года.
Повышенная жесткость способствует усиленному образованию накипи в паровых котлах, отопительных приборах и бытовой металлической посуде, что значительно снижает интенсивность теплообмена. В воде с высокой жесткостью плохо развариваются овощи и мясо, так как катионы кальция образуют с белками пищевых продуктов нерастворимые соединения. Большая магниевая жесткость придает воде горький привкус, поэтому содержание магния не должно превышать 100 мг/л. Общая жесткость питьевой воды во избежание ухудшения ее органолептических свойств должна быть не более 7 ммоль экв/л.
Для устранения или уменьшения жесткости воды применяют специальные методы. Из реагентных методов наиболее распространен известково-содовый, а при комбинировании его с ионообменными методами можно получить глубоко умягченную воду.
Ход анализа
Поместите 100 мл исследуемой воды в коническую колбу. Прибавьте 20 мл аммонийного буферного раствора (рН = 10) и на кончике шпателя - несколько кристалликов индикатора эриохрома черного Т или кислотного хром темно-синего. Раствор перемешайте, после появления винно-красной окраски титруйте 0,05 н. раствором трилона Б до перехода окраски в синюю. Титрование повторите не менее трех раз, до получения хорошо сходимых результатов.
Результаты рассчитайте в ммоль экв/л.
Определение нитратов потенциометрическим методом
с ион-селективным электродом
Предельно допустимая концентрация нитратов в воде водоемов 45 мг/л, лимитирующий показатель вредности санитарно-токсикологический.
Массовую долю нитратов в миллионных долях находят по величине рС(NO3-) с помощью данных, приведенных в ниже представленной таблице.
Ход анализа
Для проведения анализа необходим иономер типа ЭВ-74, рН-милливольтметр рН-340 или рН-121 (с ион-селективным нитратным электродом и электродом сравнения хлорсеребряным).
Подготовка электрода к работе. До начала работы заполните электрод водным раствором, содержащим нитрат калия и хлорид калия (10,11 г KNO3 и 0,37 г KCl растворите в мерной колбе на 1 л и доведите до метки дистиллированной водой). После этого электрод сутки выдерживайте в 0,1 М растворе KNO3. Перед началом работы нитратный электрод поместите на 10 минут в стаканчик с дистиллированной водой.
50 мл воды поместите в стаканчик и измеряйте концентрацию иона нитрата. Перед измерением ион - селективный электрод тщательно ополосните дистиллированной водой и выдерживайте его в дистиллированной воде 10 мин. Измерения повторите три раза и возьмите среднеарифметическое значение трех измерений.
Измерение концентрации иона нитрата проводите непосредственно в логарифмических единицах рС(NO3-) = -lgС(NO3-) по шкале иономера, предварительно отградуированного по растворам сравнения.
Определение активного хлора
Хлор активный (суммарное содержание свободного хлора, хлорноватистой кислоты, гипохлорит - ионов и хлораминов) в воде водоемов должен отсутствовать, лимитирующий показатель вредности общесанитарный.
Метод основан на том, что свободный хлор, хлорноватистая кислота, гипохлорит - ионы и хлорамины в кислой среде выделяют из йодида калия йод, который оттитровывают тиосульфатом в присутствии крахмала.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2438; Нарушение авторских прав?; Мы поможем в написании вашей работы!