
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электроотрицательность атомов и групп
|
|
|
|
Электроотрицательность – это свойство атома, соединенного ковалентной связью с другим атомом. Если в связи А–В электронное облако смещено в сторону А, то А более электроотрицателен, чем В.
Наибольшая электроотрицательность присуща атомам, расположенным в правом верхнем углу, наименьшая – в нижнем левом углу периодической системы. Таким образом, электроотрицательность растет слева направо по периодам и снизу вверх в группах.
В пределах главного периода она пропорциональна эффективному заряду ядра (для 2-го периода: С ® F). Внутри группы она тем больше, чем меньше степень экранирования ядер электронами: F > Cl > Br > I.
Рассмотрим энергии связей трех молекул:
A–A B–B
EA–A EB–B
A–B
EA–B
Экспериментально установлено, что
EA–B > 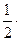 (EA–A + EB–B)
(EA–A + EB–B)
Электроотрицательность рассматривают в основном по шкале Полинга. Полинг предположил, что
χA – χB = f (Δ)
где Δ = EA–B – 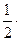 (EA–A + EB–B)
(EA–A + EB–B)
Эмпирически было найдено, что эта зависимость является квадратичной.
Если произвольно приписать χF = 4, то остальным атомам можно присвоить такие значения элетроотрицательностей, что будет справедливо соотношение
│χA – χB│ = 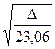 = 0,208
= 0,208 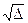 ,
,
где Δ – в ккал/моль;
23,06 – переводной коэффициент из ккал/моль в эВ/моль, помноженный на 104.
Полученная таким образом эмпирическая шкала Полинга выглядит следующим образом:
Таблица 5
Шкала Полинга:
| Атом | H | Li | Be | B | C | N | O | F | Na | Mg | Al | Si | P | S | Cl |
| χ | 2,1 | 1,0 | 1,5 | 2,0 | 2,5 | 3,0 | 3,5 | 4,0 | 0,9 | 1,2 | 1,5 | 1,8 | 2,1 | 2,5 | 3,0 |
По Малликену c = 1/2 (E + I), где E – сродство к электрону, I – энергия ионизации атома в данном валентном состоянии.
Электроотрицательность по Малликену линейно пропорциональна электроотрицательности по Полингу.
Электроотрицательность атома зависит от эффективного заряда атома в конкретной молекуле и от состояния его гибридизации, т. е. не является фиксированной величиной.
Таблица 6
Электроотрицательность атома углерода в различных гибридных состояниях:
| Тип связи | 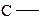
| 
| 
| 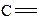
| 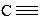
| 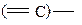
| 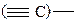
|
| Состояние гибридизации атома углерода | sp3 | sp2 | sp | ||||
| χ | 2,6 | 2,3 | 2,7 | 2,1 | 2,0 | 2,8 | 3,2 |
Следовательно, электроотрицательность одного и того же многовалентного атома различна в направлении различных связей и зависит от других заместителей, входящих в состав молекулы. особенно от атомов, непосредственно соединенных с рассматриваемым. Поэтому имеет смысл рассчитать электроотрицательность и для атомных групп:
Таблица 7
Электроотрицательность групп
| Группа | NO2 | CºN | СF3 | C6H5 | CCl3 | CBr3 | CH3 | СºСH | COOH | СH=O |
| χ | 3,42 | 3,21 | 2,99 | 2,72 | 2,67 | 2,56 | 2,47 | 3,2 | 2,9 | 2,9 |
Сведения об электроотрицательности можно получить из спектров ЯМР. Химический сдвиг протона приблизительно пропорционален электронной плотности вокруг него, и, следовательно, электроотрицательности атома или группы, с которыми он связан. Чем выше электроотрицательность атома или группы, тем ниже электронная плотность вокруг связанного с ними протона и тем в большей степени сдвинут сигнал протона в слабое поле.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1307; Нарушение авторских прав?; Мы поможем в написании вашей работы!