
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Влияние различных факторов на скорость химических реакций
|
|
|
|
Скорость реакции зависит от природы реагирующих веществ и от условий протекания реакции: концентрации реагентов, температуры и присутствия катализаторов. Для реакций с участием твердых веществ, скорость реакции зависит также от степени их измельчения (дисперсности), а для газов – от давления, т.к. в этом случае с изменением давления меняется концентрация реагентов.
1. Зависимость скорости реакции от природы реагирующих веществ:
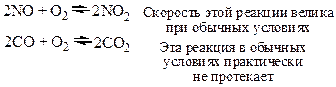
2. Зависимость скорости реакции от концентрации для элементарных процессов выражается законом действующих масс, который был открыт в 1867 году норвежскими учеными К.Гульдбергом и П.Вааге. Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. Математически этот закон для уравнения реакции А + В = АВ можно представить в следующем виде:
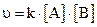 (3),
(3),
где [A] и [B] – молярные концентрации веществ; k – константа скорости химической реакции, численно равная скорости реакции, когда произведение концентраций реагирующих веществ равно единице.
Константа скорости зависит только от природы реагирующих веществ, температуры и присутствия катализаторов, но не зависит от концентраций реагирующих веществ. Константа скорости является удобной характеристикой для сопоставления скоростей различных реакций. Для реакций, в которых участвуют несколько молекул, концентрации берутся с соответствующим показателем степени (при условии, что реакция не происходит в две и более стадии). Так, для реакции аА + вВ = сАВ скорость химической реакции равна:
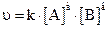 (4),
(4),
Пример 1: 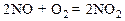
 , т.е. концентрация возводится в степень, равную коэффициенту в уравнении.
, т.е. концентрация возводится в степень, равную коэффициенту в уравнении.
Закон действующих масс справедлив только для наиболее простых по своему механизму взаимодействий, протекающих в газах или в разбавленных растворах (гомогенные системы). Если в реакции участвуют два вещества, то скорость реакции иногда зависит от концентрации одного из них и не зависит от концентрации другого.
В реакциях с участием твердых веществ (гетерогенные системы) скорость зависит от поверхности соприкосновения между реагирующими веществами и не зависит от массы твердого вещества:
С(тв.) + О2 (г.) = СО2 (г.) υ = k[O2],
Характер зависимости скорости реакции от концентрации реагирующих веществ определяется ее порядком, равным сумме показателей степеней в уравнении закона действующих масс. Порядок реакции, приведенной в примере 1 равен 2 + 1 =3.
Часто имеет место несовпадение порядка реакции с суммой коэффициентов. Это обусловлено тем, что рассматриваемая реакция протекает в несколько стадий.
Пример 2:
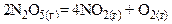
Порядок этой реакции равен единице и выражение скорости реакции записывается как 
 , а не
, а не 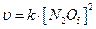 , т.к. реакция идет по стадиям:
, т.к. реакция идет по стадиям:

Общая скорость таких реакций определяется скоростью более медленной стадии. В этом примере – скоростью первой стадии.
Молекулярность реакции – число молекул, принимающих участие в элементарном акте химического взаимодействия. Различают моно-, би-, три-, и т.д. молекулярные реакции. Чаще всего встречаются бимолекулярные реакции.
Зависимость скорости реакции от температуры. Энергия активации.
В большинстве случаев нагревание резко повышает скорость химической реакции. Например, осуществить синтез воды из водорода и кислорода при небольшой температуре и без катализаторов практически невозможно. Но при температуре 600?С скорость химической реакции возрастает настолько, что реакция идет со взрывом.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа (1884г).
При повышении температуры на каждые 10?С, скорость химической реакции возрастает примерно в 2-4 раза.
Правило Вант-Гоффа выражается следующим уравнением:
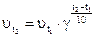 (5),
(5),
где  - первоначальная скорость химической реакции при температуре t1;
- первоначальная скорость химической реакции при температуре t1;
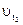 - скорость химической реакции при температуре t2;
- скорость химической реакции при температуре t2;
 - температурный коэффициент скорости химической реакции, находящийся в пределах от 2 до 4.
- температурный коэффициент скорости химической реакции, находящийся в пределах от 2 до 4.
При повышении температуры скорость движения молекул возрастает пропорционально величине, равной корню квадратному из абсолютной температуры. Так, отношение скоростей движения молекул при 100°С и 0°С равняется 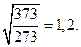 Во столько же раз возрастает и число столкновений между молекулами, а скорости химических реакций возрастают в тысячи и десятки тысяч раз. Следовательно, скорость химической реакции зависит не только от скорости движения молекул, но и от других причин.
Во столько же раз возрастает и число столкновений между молекулами, а скорости химических реакций возрастают в тысячи и десятки тысяч раз. Следовательно, скорость химической реакции зависит не только от скорости движения молекул, но и от других причин.
Не каждое столкновение молекул заканчивается их химическим взаимодействием. Химическое взаимодействие молекул происходит лишь в том случае, если молекулы приближаются на расстояние, при котором происходит перераспределение электронной плотности и возникновение новых химических связей. Т.е. сталкивающиеся молекулы должны обладать энергией, необходимой для преодоления сил отталкивания (энергии барьера) между их электронными оболочками. Частицы, обладающие такой энергией, называют активными.
Избыточная (по сравнению со средней) энергия, которой должна обладать молекула для того, чтобы она могла вступить в химическое взаимодействие, называется энергией активации (Е).
Группировку активных частиц, находящихся в процессе взаимодействия (т.е. перераспределения связей), называют активным комплексом.
Пример:
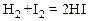
Эта реакция хорошо изучена, поэтому сейчас и далее мы будем на ее примере говорить о скорости химической реакции. Реакция протекает через образование промежуточного активного комплекса H2I2.
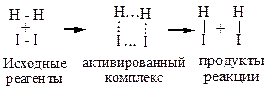
В активированном комплексе связи H-I образуются одновременно с разрывом связи H-H и I-I. Это приводит к тому, что энергия активации оказывается меньше, чем энергия разрыва связей в молекулах исходных веществ. Величина энергии разрыва связей в молекулах Н2 и I2 равна 140ккал, а величина энергии активации – 40ккал. Следовательно, образование переходного активного комплекса энергетически более выгодно, чем протекание реакции через полный разрыв связей молекул исходных веществ.
Для большинства реакций величина энергии активации находится в пределах 15-60ккал/моль.
Образование активированного комплекса характеризуется непрерывным изменением расстояний между взаимодействующими атомами. В этом заключается его существенное отличие от обычной молекулы, в которой средние расстояния между атомами не зависят от времени. Активированный комплекс соответствует такому состоянию системы, при котором потенциальная энергия достигает максимального значения. Последовательность промежуточных состояний, через которые проходит система в ходе элементарного акта, называется путем, или координатой реакции.

Рис.1. Реакционный путь процесса H2(г) + I2(г) = 2HI(г)
Т.к. прямая реакция (переход из состояния I в состояние II) является экзотермической, то общий запас энергии продуктов реакции меньше, чем исходных веществ. В результате реакции система перешла на более низкий энергетический уровень. Разность уровней I и II равна тепловому эффекту реакции (ΔН). Уровень К соответствует переходному активированному комплексу H2I2. разность между К и уровнем I представляет собой энергию активации прямой реакции  , а разность между К и уровнем II – энергию активации обратной реакции
, а разность между К и уровнем II – энергию активации обратной реакции  .
.
Зависимость скорости реакции от температуры и энергии активации строго определяется уравнением Аррениуса для вычисления константы скорости химической реакции:
 (6),
(6),
где А – предэкспоненциальный множитель, или фактор частоты, связанный с вероятностью и числом столкновений молекул;
е – основание натурального логарифма;
Е – энергия активации;
R – универсальная газовая постоянная;
Т – абсолютная температура.
Влияние катализатора на скорость реакции
Катализаторы – вещества, изменяющие скорость химической реакции, но сами остающиеся в конце реакции химически неизменными.
Изменение скорости химической реакции под действием катализатора называется катализом.
Катализаторы, увеличивающие скорость химической реакции, называются положительными, а катализаторы, уменьшающие скорость реакции – отрицательными, или ингибиторами.
Существует два вида катализа: гомогенный и гетерогенный.
Гомогенный катализ – процесс, при котором катализатор и реагирующие вещества находятся в одной фазе.
Гетерогенный катализ – процесс, при котором катализатор и реагирующие вещества находятся в разных фазах.
Сущность механизма действия катализатора при гомогенном катализе заключается в образовании промежуточного реакционноспособного соединения.
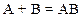
В присутствии катализатора (К) эта реакция протекает в две стадии:

Механизм реакции гомогенного катализа для уравнения реакции: А + В = С представлен графически на рис.9.2.

Рис.9.2. Изменение энергии реакционной системы вдоль пути реакции с катализатором и без него.
В присутствии катализатора реакция протекает в две стадии:
I стадия: А + К = АК,
II стадия: АК + В = К + С.
АК – промежуточное соединение.
Е – энергия активации без участия катализатора;
Е1 – энергия активации при образовании промежуточного соединения;
Е2 – энергия активации при разложении промежуточного соединения.
Е1 + Е2 < E. Таким образом, при участии катализатора в химической реакции энергия активации уменьшается.
Вследствие того, что энергия активации одной стадии заменяется меньшими энергиями Е1 и Е2 двух последних стадий, скорость химической реакции возрастает. Если даже Е1 + Е2 >Е, но Е1 и Е2 меньше Е, то и в этом случае скорость реакции возрастает.
Механизм гетерогенного катализа иной, и объясняется теорией активированной адсорбции.
Адсорбция – свойство вещества поглощать на своей поверхности другие вещества.
На поверхности катализатора адсорбируются реагирующие вещества (за счет того, что поверхность катализатора неоднородна и на ней имеются так называемые активные центры). Процесс протекает в несколько стадий, и промежуточными являются поверхностные соединения. Это приводит к снижению энергии активации. В общем случае катализатор ведет реакцию по другому пути, чем тот, по которому реакция протекает без катализатора.
Катализатор всегда измельчают и наносят на инертный носитель с развитой поверхностью (пемза, асбест).
Например, синтез аммиака на железном катализаторе:
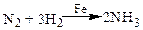
Лекция
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3484; Нарушение авторских прав?; Мы поможем в написании вашей работы!