
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Квантовые числа электрона в атоме водорода. Вырождение
|
|
|
|
Рассмотрим пример квантования водородоподобного атома.
Для начала рассмотрим частный случай, когда волновая функция ψ электрона в атоме зависит только от радиуса r – расстояние электрона от атомного ядра.
Тогда потенциальная энергия электрона в поле ядра
 , (7.1)
, (7.1)
а уравнение Шредингера для атома водорода будет иметь вид:

или  . (7.2)
. (7.2)
Последнее уравнение описывает стационарное состояние электрона в атоме водорода. Решение его показывает, что электрон в атоме водорода обладает дискретным энергетическим спектром, а собственные значения энергии определяются уравнением
 , (7.3)
, (7.3)
что соответствует значениям энергии электрона по теории Бора.
Если уравнение (7.2) рассматривать для более сложного атома с зарядом ядра Ze, и учитывать при этом, что движение электрона происходит в центрально – симметричном поле, созданном ядром вместе со всеми атомными электронами, то наиболее удобным является представление уравнения Шредингера в сферической системе координат. Из рис. 7.1. видно, что положение частицы в сферической системе координат может быть определено через отрезок ОР = r, угол Θ, образуемый прямой ОР с осью Z, и угол  между осью Х и проекцией ОР на координатную плоскость ХУ.
между осью Х и проекцией ОР на координатную плоскость ХУ.
Рис. 7.1.
В этом случае волновая функция ψ будет зависеть от координат z,  ,
,  . Для решения уравнения Шредингера в сферической системе координат необходимо, чтобы функция
. Для решения уравнения Шредингера в сферической системе координат необходимо, чтобы функция 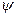 представляла собой произведение трех независимых функций:
представляла собой произведение трех независимых функций:  ,
,  , Ф
, Ф  .
.
В вязи с тем, что для атома водорода потенциальное поле является сферически – симметричным (то есть определяется лишь расстоянием от центра атома и совсем не зависит от направления), то уравнение Шредингера для атома водорода в сферической системе координат имеет вид:

При решении уравнения Шредингера для атома водорода находят функции
 ,
,  , Ф
, Ф  , отвечающие условиям конечности, которые можно получить только при введении трех целых квантовых чисел n,
, отвечающие условиям конечности, которые можно получить только при введении трех целых квантовых чисел n,  и me . Произведение этих трех функций определяет волновую функцию, характеризующую состояние электрона в атоме водорода. Для каждого энергетического состояния волновая функция имеет вид, определяемый различными комбинациями квантовых чисел.
и me . Произведение этих трех функций определяет волновую функцию, характеризующую состояние электрона в атоме водорода. Для каждого энергетического состояния волновая функция имеет вид, определяемый различными комбинациями квантовых чисел.
При решении уравнения Шредингера относительно функций Θ и Ф оказывается, что функция Ф дает приемлемые решения только при условии введения целых чисел 0,  ,
, 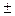 2…. Следовательно, чтобы установить зависимость электронной плотности от угла
2…. Следовательно, чтобы установить зависимость электронной плотности от угла 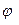 , необходимо ввести целое число -
, необходимо ввести целое число - 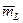 . Далее оказывается, что для каждого значения числа
. Далее оказывается, что для каждого значения числа  функция
функция  приводит к допустимым решениям только при введении второго числа
приводит к допустимым решениям только при введении второго числа  , которое всегда положительно и не может быть меньше
, которое всегда положительно и не может быть меньше  , а для каждой комбинации значений чисел
, а для каждой комбинации значений чисел  и
и  функция R дает допустимые решения при введении третьего, главного квантового числа n, которое всегда больше
функция R дает допустимые решения при введении третьего, главного квантового числа n, которое всегда больше  . Итак, в общем случае когда
. Итак, в общем случае когда  ,
,  , Ф
, Ф  , физически приемлемые решения получаются только при введении целых чисел
, физически приемлемые решения получаются только при введении целых чисел  ,
,  ,
,  . Каждая комбинация из этих чисел соответствует определенному электронному состоянию.
. Каждая комбинация из этих чисел соответствует определенному электронному состоянию.
В результате получим, что значения энергии в стационарных состояниях водородоподобного атома по-прежнему зависят только от главного квантового числа n (формула 7.3). Но состояния с заданным n (то есть с заданной энергией 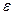 ) могут отличаться одно от другого различными значениями квантовых чисел (
) могут отличаться одно от другого различными значениями квантовых чисел ( и ml). Таким образом, одному и тому же значению
и ml). Таким образом, одному и тому же значению 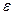 соответствуют несколько различных квантовых состояний. В этом случае говорят, что состояние с энергией
соответствуют несколько различных квантовых состояний. В этом случае говорят, что состояние с энергией 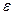 вырождено. Энергетический уровень
вырождено. Энергетический уровень 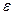 называют также вырожденным.
называют также вырожденным.
Число независимых состояний, суперпозицией которых может быть получено заданное состояние с энергией 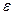 , называется степенью или кратностью вырождения.
, называется степенью или кратностью вырождения.
Найдем степень вырождения для водородоподобного атома в состоянии с заданным главным квантовым числом n.
Физический смысл квантовых чисел состоит в следующем.
Главное квантовое число n определяет номер энергетичского уровня и является мерой полной энергии электрона.
Орбитальное квантовое число l характеризует величину механического момента импульса электрона Pl относительно ядра в данном квантовом состоянии:
 (7.4)
(7.4)
Оно может принимать значения  0, 1, 2, … n -1. Равенство
0, 1, 2, … n -1. Равенство  указывает на то, что в этом состоянии электрон находится не в покое, а перемещается равномерно в любом направлении сферы, в результате чего его момент импульса в среднем оказывается равным нулю. (В классической теории
указывает на то, что в этом состоянии электрон находится не в покое, а перемещается равномерно в любом направлении сферы, в результате чего его момент импульса в среднем оказывается равным нулю. (В классической теории 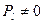 , так как в этом случае
, так как в этом случае  ).
).
Таким образом, при заданном  число
число  может принимать
может принимать  значений и соответствующих им квантовых состояний с определенными
значений и соответствующих им квантовых состояний с определенными  и
и  .
.
При  система вырождена.
система вырождена.
Возможные значения  определяют количество подуровней (подоболочек), на которые расщепляются основные энергетические уровни (основные оболочки) атома при данном значении квантового числа
определяют количество подуровней (подоболочек), на которые расщепляются основные энергетические уровни (основные оболочки) атома при данном значении квантового числа  . Для обозначения подуровней применяют буквенные символы: подоболоча при
. Для обозначения подуровней применяют буквенные символы: подоболоча при  называется
называется  - подоболочкой и т. д.(см. табл.)
- подоболочкой и т. д.(см. табл.)

| ||||||
| Условное обозначение |

|

|

| f |

|

|
Чтобы определить принадлежность подоболочки к основному состоянию, перед буквенным символом ставится значение  , то есть указывается соответствующий номер электронной оболочки. Например, символ
, то есть указывается соответствующий номер электронной оболочки. Например, символ  означает электронное состояние, для которого
означает электронное состояние, для которого  ,
,  ; символ
; символ 
 - состояние, для которого
- состояние, для которого  ,
,  и т. д.
и т. д.
Магнитное квантовое число 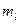 характеризует проекцию момента импульса на полярную ось
характеризует проекцию момента импульса на полярную ось  :
:
 (7.5)
(7.5)
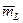 может принимать значения 0,
может принимать значения 0,  ,
, 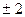 , …,
, …, 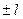 . Таким образом, при заданном
. Таким образом, при заданном  число
число  может принимать
может принимать  значений.
значений.
Поэтому полное число квантовых состояний, с помощью которых может реализоваться состояние с заданным  , равно
, равно
 . (7.6)
. (7.6)
Как будет показано далее, с учетом спина, число квантовых состояний будет в два раза больше, то есть  .
.
2. Вид волновых функций и распределение плотности вероятности.
Как уже говорилось ранее, для каждого энергетического состояния волновая функция имеет свой вид, определяемый различными комбинациями квантовых чисел.
Так, например для 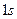 состояния (n =1,
состояния (n =1,  ), соответствующего минимальной энергии электрона, волновая функция имеет вид:
), соответствующего минимальной энергии электрона, волновая функция имеет вид:
 , (7.7)
, (7.7)
причем  А и соответствует боровскому радиусу первой электронной орбиты в атоме водорода. Следовательно, для
А и соответствует боровскому радиусу первой электронной орбиты в атоме водорода. Следовательно, для 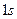 состояния (n =1,
состояния (n =1,  ), соответствующего минимальной энергии электрона, волновая функция определятся только расстоянием от центра атома и не зависит от направления, то есть от углов
), соответствующего минимальной энергии электрона, волновая функция определятся только расстоянием от центра атома и не зависит от направления, то есть от углов  и
и  . Такой класс волновых функций называется сферически-симметричными, поскольку их значения во всех точках сферы данного радиуса имеют одинаковые значения. Поэтому достаточно рассмотреть ее изменение вдоль одного из направлений.
. Такой класс волновых функций называется сферически-симметричными, поскольку их значения во всех точках сферы данного радиуса имеют одинаковые значения. Поэтому достаточно рассмотреть ее изменение вдоль одного из направлений.
Рис. 7.2.
Функция 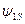 будет монотонно убывать с увеличением расстояния от ядра; наибольшее ее значение соответствует центру ядра атома.
будет монотонно убывать с увеличением расстояния от ядра; наибольшее ее значение соответствует центру ядра атома.
На рис. 7.2. приведена вероятностная кривая распределения электронной плотности 
 в атоме водорода в состоянии
в атоме водорода в состоянии 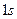 .
.
По оси абсцисс отложено расстояние от центра ядра атома, а по оси ординат – величина 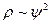 . Кривая
. Кривая  определяет электронную плотность (вероятность пребывания электрона) на расстоянии
определяет электронную плотность (вероятность пребывания электрона) на расстоянии  от ядра. Как видно из рис. 7.2., электронная плотность на расстоянии >0,2нм ничтожно мала. Следовательно, движение электрона в атоме водорода ограничивается сферой диаметром 4 А. Схематически эту сферу можно представить в виде симметричного облака вероятностей, которое называют электронным облаком.
от ядра. Как видно из рис. 7.2., электронная плотность на расстоянии >0,2нм ничтожно мала. Следовательно, движение электрона в атоме водорода ограничивается сферой диаметром 4 А. Схематически эту сферу можно представить в виде симметричного облака вероятностей, которое называют электронным облаком.
Итак, согласно квантовым представлениям, движение электрона в атоме водорода происходит не по круговой плоской орбите, а в пространстве, ограниченном сферой, внутри которой электрон может оказаться в любой точке. Так как электрон движется очень быстро относительно ядра (~0,7 скорости света), то трудно указать его местонахождение. Поэтому можно считать, что электронный заряд электрона в сфере “размазан” в облако отрицательного электричества.
Однако форма этого электронного облака, представляющего собой облако вероятности, не имеет четких границ.
Зависимость  , представленная на рис. 7.2., не позволяет оценивать наиболее вероятное нахождение электрона в состоянии
, представленная на рис. 7.2., не позволяет оценивать наиболее вероятное нахождение электрона в состоянии 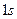 относительно ядра, то есть плотность электронного облака. Ее можно выразить через величину заряда, отнесенного к единице объема, а также определить заряд в элементе объема, например, в слое сферы с радиусами
относительно ядра, то есть плотность электронного облака. Ее можно выразить через величину заряда, отнесенного к единице объема, а также определить заряд в элементе объема, например, в слое сферы с радиусами  и
и  . Точки, находящиеся на расстоянии
. Точки, находящиеся на расстоянии  от ядра, лежат на сфере радиусом
от ядра, лежат на сфере радиусом  , поверхность которой равна
, поверхность которой равна 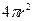 . Объем, заключенный между сферами с радиусами
. Объем, заключенный между сферами с радиусами  и
и  , равен
, равен 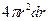 .
.
Если количество электронов в единице объема равно  , то в сферическом слое толщиной
, то в сферическом слое толщиной 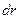 оно составит
оно составит  . Вероятность пребывания электрона в сферическом слое радиусом
. Вероятность пребывания электрона в сферическом слое радиусом  и толщиной
и толщиной 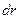 характеризуется функцией
характеризуется функцией  , умноженной на толщину слоя:
, умноженной на толщину слоя:  . Тогда для атома со сферически – симметричным электронным облаком можно записать:
. Тогда для атома со сферически – симметричным электронным облаком можно записать:
 (7.8)
(7.8)
Получаемая при этом кривая (рис 7.2.) представляет собой относительную вероятность пребывания электрона на разных расстояниях от ядра, то есть радиус вероятных орбит. Наиболее вероятное пребывание электрона в атоме водорода в состоянии 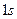 обусловлено сферой радиусом 0,52 ангстрем.
обусловлено сферой радиусом 0,52 ангстрем.
Если  , то
, то  -состояния также будут обладать сферической симметрией. Но при этом электронное облако будет представлять собой размытый шар, внутри которого существуют сферические слои с плотностью электронного облака, равной 0. На рис. 7.3 показана кривая
-состояния также будут обладать сферической симметрией. Но при этом электронное облако будет представлять собой размытый шар, внутри которого существуют сферические слои с плотностью электронного облака, равной 0. На рис. 7.3 показана кривая  для
для 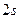 состояния, которая понимается так: электронное облако для
состояния, которая понимается так: электронное облако для 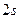 -состояния в атоме водорода представляет собой размытый шар, внутри которого имеется сферический слой, где вероятная плотность электронного облака равна 0. Электронное облако
-состояния в атоме водорода представляет собой размытый шар, внутри которого имеется сферический слой, где вероятная плотность электронного облака равна 0. Электронное облако 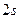 -состояния по сравнению с
-состояния по сравнению с 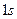 -состоянием в 5 раз больше, но плотность его в каждой точке примерно в 50 раз меньше.
-состоянием в 5 раз больше, но плотность его в каждой точке примерно в 50 раз меньше.
Вероятность пребывания электрона на разных расстояниях от центра атома в слое 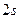 -состояния имеет два максимума: при
-состояния имеет два максимума: при  и
и  . Максимальное значение функции
. Максимальное значение функции  в точке
в точке  в несколько раз больше, чем в точке
в несколько раз больше, чем в точке  , и следовательно, электрон в состоянии
, и следовательно, электрон в состоянии 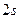 большее время пребывает на расстоянии
большее время пребывает на расстоянии 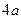 от центра атома. Это расстояние соответствует второй боровской орбите в атоме водорода. Однако в отличие от боровской теории электрон в состоянии
от центра атома. Это расстояние соответствует второй боровской орбите в атоме водорода. Однако в отличие от боровской теории электрон в состоянии 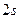 может находиться в довольно широкой области и даже может быть ближе к ядру, чем электрон в состоянии
может находиться в довольно широкой области и даже может быть ближе к ядру, чем электрон в состоянии 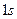 , хотя вероятность такого события очень мала.
, хотя вероятность такого события очень мала.
Рис. 7.3.
Для более высоких  -состояний соблюдаются следующие закономерности: чем больше
-состояний соблюдаются следующие закономерности: чем больше  , тем более,,размыто” электронное облако, т.е. тем на большее расстояние оно распространяется от центра атома и тем меньше его плотность: число максимумов в функции
, тем более,,размыто” электронное облако, т.е. тем на большее расстояние оно распространяется от центра атома и тем меньше его плотность: число максимумов в функции  равно квантовому числу
равно квантовому числу  . При
. При  - состоянии электрон большее время пребывает в области пространства, соответствующего
- состоянии электрон большее время пребывает в области пространства, соответствующего  -му максимуму функции
-му максимуму функции  . Следовательно, чем больше значение квантового числа
. Следовательно, чем больше значение квантового числа  , тем большее время и на большем расстоянии от центра атома находится электрон. В тоже время электрон может находиться и совсем в другой точке пространства, но вероятность такого события ничтожно мала.
, тем большее время и на большем расстоянии от центра атома находится электрон. В тоже время электрон может находиться и совсем в другой точке пространства, но вероятность такого события ничтожно мала.
До сих пор речь шла о  - состояниях, соответствующих
- состояниях, соответствующих  . Как было показано, при
. Как было показано, при  ,,орбита” имеет вид окружности, при
,,орбита” имеет вид окружности, при  1, 2, 3… она переходит в эллипс, все более вытянутый с ростом
1, 2, 3… она переходит в эллипс, все более вытянутый с ростом 
Рис. 7.4.
Каждая подоболочка с числом  включает
включает  эквивалентных состояний электрона. Только при
эквивалентных состояний электрона. Только при  состояния являются однократными. Неравенство
состояния являются однократными. Неравенство  нулю указывает на сгущение электронного облака в определенном направлении. Орбиты с
нулю указывает на сгущение электронного облака в определенном направлении. Орбиты с  1, 2, 3…, проникая в область пространства, где проходят орбиты заполненных оболочек, испытывают дополнительное взаимодействие с орбитами атомного остатка, вследствие чего
1, 2, 3…, проникая в область пространства, где проходят орбиты заполненных оболочек, испытывают дополнительное взаимодействие с орбитами атомного остатка, вследствие чего  ,
,  ,
,  ,
,  ,
,  состояния характеризуются ярко выраженной концентрацией электронной плотности вдоль некоторых прямых.
состояния характеризуются ярко выраженной концентрацией электронной плотности вдоль некоторых прямых.
В случае, если  ,
,  ,
,  , то при
, то при  (рис. 7.5.) электронное облако вытягивается вдоль оси z (в направлении вектора магнитного поля), при
(рис. 7.5.) электронное облако вытягивается вдоль оси z (в направлении вектора магнитного поля), при  - вдоль оси х, а при
- вдоль оси х, а при  - вдоль оси y. Таким образом, при
- вдоль оси y. Таким образом, при  электронное облако является трижды вырожденным.
электронное облако является трижды вырожденным.
Рис 7.5.
Поскольку электроны тождественны, то возможно сложение облаков отдельных электронов, что позволяет судить о суммарной плотности электронного облака на данной подоболочке. Так, в атоме азота в  -состоянии находятся три электрона: один при
-состоянии находятся три электрона: один при  , второй при
, второй при  и третий при
и третий при  . Каждый из трех электронов вследствие действия ядерного поля с зарядом
. Каждый из трех электронов вследствие действия ядерного поля с зарядом 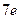 и соседних электронов будет иметь картину вероятности пребывания в разных областях пространства. аналогичную представленной на рис. 7.5., результирующее же электронное облако этих трех электронов будет обладать сферической симметрией.
и соседних электронов будет иметь картину вероятности пребывания в разных областях пространства. аналогичную представленной на рис. 7.5., результирующее же электронное облако этих трех электронов будет обладать сферической симметрией.
Поскольку формулы для энергий водородоподобного атома в теории Бора и в квантовой механике не отличаются, схема уровней атома водорода совпадает со схемой уровней по теории Бора.
3. Спин-орбитальное взаимодействие и тонкая структура.
Если наличие трех квантовых чисел  ,
,  ,
,  вполне достаточно для описания атома водорода, то для многоэлектронного атома их мало, необходимо введение четвертого квантового числа
вполне достаточно для описания атома водорода, то для многоэлектронного атома их мало, необходимо введение четвертого квантового числа  , называемого спиновым квантовым числом.
, называемого спиновым квантовым числом.
Спин орбитальное взаимодействие и тонкая структура 
Спиновое же число  определяет проекции вектора
определяет проекции вектора 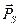 на выделенное направление. Если атом уже находится в состоянии с определенным значением орбитального момента
на выделенное направление. Если атом уже находится в состоянии с определенным значением орбитального момента 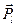 , то выделенное направление (ось z)определяется вектором
, то выделенное направление (ось z)определяется вектором 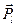 . Спин
. Спин 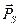 может быть ориентирован либо по
может быть ориентирован либо по 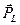 , либо против
, либо против 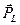 . Это означает, что проекция вектора
. Это означает, что проекция вектора 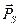 на это выделенное направление в случае атома водорода и водородоподобных атомов может принимать только два значения:
на это выделенное направление в случае атома водорода и водородоподобных атомов может принимать только два значения:
 , где
, где 
При  весь момент количества движения спиновый:
весь момент количества движения спиновый: . Если состояние атома таково, что одна из проекций
. Если состояние атома таково, что одна из проекций  ,
, 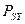 ,
,  имеет определенное значение
имеет определенное значение  , то соответствующая ось и определяет выделенное направление в атоме. Модуль вектора спина определяется как
, то соответствующая ось и определяет выделенное направление в атоме. Модуль вектора спина определяется как  , где
, где  -квантовое число, которое имеет смысл наибольшего значения. Которое может принимать проекция вектора на избранное направление, в случае электрона.
-квантовое число, которое имеет смысл наибольшего значения. Которое может принимать проекция вектора на избранное направление, в случае электрона.
При наличии орбитального 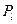 и спинового
и спинового  , они складываются в полный момент количества движения
, они складываются в полный момент количества движения  по правилам векторного сложения:
по правилам векторного сложения:

Проекция полного момента на избранное направление может принимать значения:
 , где
, где 
 -называется квантовым числом проекции полного момента.
-называется квантовым числом проекции полного момента.
Проекция орбитального момента на избранное направление имеет вид:
 ,
,
-где  - магнитное квантовое число, которое может принимать значения
- магнитное квантовое число, которое может принимать значения  0,
0, 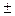 1,
1, 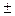 2, …
2, … 
Модуль вектора орбитального механического момента определяется как
 ,
,
-где  -квантовое число, которое имеет смысл наибольшего значения, которое может принимать проекция вектора на избранное направление.
-квантовое число, которое имеет смысл наибольшего значения, которое может принимать проекция вектора на избранное направление.
А модуль полного момента импульса будет иметь вид
 ,
,
-где  - квантовое число, которое имеет смысл наибольшего значения, которое может принимать проекция вектора на избранное направление, то есть
- квантовое число, которое имеет смысл наибольшего значения, которое может принимать проекция вектора на избранное направление, то есть 
 - называют внутренним квантовым числом.
- называют внутренним квантовым числом.
Для электрона  , то есть полный момент импульса может принимать только два значения в зависимости от того, как ориентирован спиновый магнитный момент: в направлении орбитального магнитного момента, или против него.
, то есть полный момент импульса может принимать только два значения в зависимости от того, как ориентирован спиновый магнитный момент: в направлении орбитального магнитного момента, или против него.
Взаимодействие между спиновым и орбитальным магнитными моментами электрона называется спин-орбитальным взаимодействием.
Расщепление энергетического уровня в результате спин-орбитального взаимодействия называется тонкой структурой уровня. Совокупность подуровней, на который расщепился рассматриваемый уровень, называется мультиплетом. В случае одного электрона происходит расщепление каждого энергетического уровня на два подуровня. Такая совокупность подуровней называется дуплетом. Исключением является случай, когда атом находится в  - состоянии, поскольку в этом состоянии у атома нет орбитального магнитного момента, так что спин-орбитальное взаимодействие пропадает. Такие уровни не расщепляются на подуровни и называются синглетами.
- состоянии, поскольку в этом состоянии у атома нет орбитального магнитного момента, так что спин-орбитальное взаимодействие пропадает. Такие уровни не расщепляются на подуровни и называются синглетами.
Величина тонкого расщепления энергетических уровней для легких атомов не превышает  эВ и сильно возрастает с увеличением заряда ядра. Для тяжелых атомов она может достигать десятых долей эВ, так что в этих случаях нет смысла называть расщепление,,тонким”.
эВ и сильно возрастает с увеличением заряда ядра. Для тяжелых атомов она может достигать десятых долей эВ, так что в этих случаях нет смысла называть расщепление,,тонким”.
В случае многоэлектронных атомов достаточно ограничится рассмотрением только наружных, валентных электронов, так как внутренние оболочки атома полностью заполнены электронами.
В этом случае моменты количества движения внутренних электронов, как орбитальные, так и спиновые, полностью скомпенсированы, то есть полные моменты внутренних оболочек равны нулю.
Если, к примеру, наружная оболочка атома состоит из двух электронов, то возможны два случая: 1) спины электронов направлены противоположно, а потому  2) спины электронов параллельны, тогда
2) спины электронов параллельны, тогда 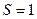 .
.
Таким образом, в случае многоэлектронных атомов  может принимать различные значения: целые (0, 1, 2, 3, …) – при четном количестве электронов, дробные
может принимать различные значения: целые (0, 1, 2, 3, …) – при четном количестве электронов, дробные  при нечетном количестве электронов. Здесь необходимо отметить, что при переходе от одноэлектронной системы к многоэлектронной, при записи вантовых чисел
при нечетном количестве электронов. Здесь необходимо отметить, что при переходе от одноэлектронной системы к многоэлектронной, при записи вантовых чисел  и
и  используют не строчные, а прописные буквы.
используют не строчные, а прописные буквы.
Тогда внутренне квантовое число 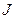 (а, значит, и величина полного механического момента может принимать
(а, значит, и величина полного механического момента может принимать  значений:
значений:
 , всего
, всего  значений.
значений.
Другими словами, в общем случае энергетический уровень может расщепляется на  подуровней. Число
подуровней. Число  называется мультиплетностью уровня. Оно показывает, сколькими способами спин может ориентироваться относительно направления орбитального момента.
называется мультиплетностью уровня. Оно показывает, сколькими способами спин может ориентироваться относительно направления орбитального момента.
В спектроскопии состояние валентных электронов характеризуют квантовым числом  , причем для записи используют вместо строчных (маленьких) букв (как в случае одного электрона) прописные (большие) буквы латинского алфавита, то есть пользуются следующей схемой:
, причем для записи используют вместо строчных (маленьких) букв (как в случае одного электрона) прописные (большие) буквы латинского алфавита, то есть пользуются следующей схемой:
| Квантовое число L | |||||||||
| Обозначение состояния | S | P | D | F | G | H | J | K | L |
В качестве нижнего индекса справа от соответствующей буквы ставят квантовое число полного момента J, а в качестве верхнего индекса слева - число  . По этому числу можно вычислить не только значение
. По этому числу можно вычислить не только значение  . Но и число уровней, на которое расщепляется рассматриваемый уровень из-за спин орбитального взаимодействия. При расщеплении на два подуровня получаем дуплет, на три подуровня – триплет, на четыре подуровня – квартет, на пять подуровней – квинтет и т. д.
. Но и число уровней, на которое расщепляется рассматриваемый уровень из-за спин орбитального взаимодействия. При расщеплении на два подуровня получаем дуплет, на три подуровня – триплет, на четыре подуровня – квартет, на пять подуровней – квинтет и т. д.
В случае двух валентных электронов при антипаралельных направлениях спина получим  ,
,  , то есть все уровни синглетны. Различным значениям
, то есть все уровни синглетны. Различным значениям  соответствуют следующие уровни:
соответствуют следующие уровни:
| L=J | |||||||
| Уровни |

|

|

|

|

|

|

|
В случае параллельных спинов 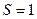 ,
,  , то есть все уровни, кроме
, то есть все уровни, кроме  , триплетны. Здесь возможны три случая:
, триплетны. Здесь возможны три случая: 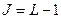 ;
; 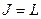 ;
;  .
.
В соответствии с этим получается таблица.
| L | |||||
| J | 0 1 | 0 1 2 | 1 2 3 | 2 3 4 | 3 4 5 |
| Уровни |
 
|
  
|
  
|
  
|
  
|
В общем случае перед такой записью необходимо указывать численное значение главного квантового числа  .
.
Например, запись 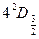 читается как,,четыре, дуплет,
читается как,,четыре, дуплет,  ” и означает, что
” и означает, что 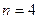 ;
;  ;
; 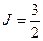 ;
; 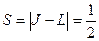 ;
; 
Следует различать тонкую структуру спектральных термов (или энергетических уровней) и тонкую структуру спектральных линий.
Для атомов с одним валентным электроном термы обозначаются строчными (малыми) буквами латинского алфавита. Энергия уровня зависит от квантовых чисел  ,
,  ,
,  , но в отсутствие магнитного и электрического полей не зависит от магнитного квантового числа.
, но в отсутствие магнитного и электрического полей не зависит от магнитного квантового числа.
В случае водорода и водородоподобных атомов имеет место случайное вырождение по  из-за того, что электрическое поле ядра, в котором движется единственный электрон атома – кулоновское.
из-за того, что электрическое поле ядра, в котором движется единственный электрон атома – кулоновское.  . В этом случае энергия уровня зависит только от квантовых чисел
. В этом случае энергия уровня зависит только от квантовых чисел  и
и  .
.
Расщепление спектральной линии на несколько близко расположенных компонент определяется разрешенными переходами между различными подуровнями расщепившихся энергетических уровней, то есть правилами отбора.
При соответствующих квантовых переходах, сопровождающихся излучением света, число  может меняться только на единицу:
может меняться только на единицу: 
соответственно  или
или  .
.
Этот и аналогичные результаты получили название правил отбора. Остальные комбинации запрещены. Это не значит, что соответствующие переходы вообще невозможны. Правила отбора относятся только к дипольному излучению и поглощению света и не относятся к другим процессам, которые могут происходить в атомах.
На изменение главного квантового числа  никакие ограничения не накладываются.
никакие ограничения не накладываются.
В качестве примера рассмотрим тонкую структуру линии  серии Лаймана водорода:
серии Лаймана водорода:

Терм 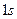 - синглетный, терм
- синглетный, терм  - дуплетный, так как состоит из двух подтермов -
- дуплетный, так как состоит из двух подтермов - 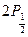 и
и  . Правила отбора допускают переход с обоих уровней
. Правила отбора допускают переход с обоих уровней  на уровень
на уровень  . Поэтому линия
. Поэтому линия  должна быть дуплетом, то есть состоять из двух спектральных линий (рис. 7.6).
должна быть дуплетом, то есть состоять из двух спектральных линий (рис. 7.6).
Рис. 7.6.
Расстояние между линиями 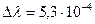 нм. Длинна волны самой линии
нм. Длинна волны самой линии  составляет
составляет  нм. Для разрешения тонкой структуры линии
нм. Для разрешения тонкой структуры линии  спектральный прибор должен иметь разрешающую способность не менее
спектральный прибор должен иметь разрешающую способность не менее  .
.
Аналогично дуплетную структуру имеют и остальные линии серии Лаймана.
В качестве второго примера рассмотрим тонкую структуру линии 
 серии Бальмера водорода. Главному квантовому числу
серии Бальмера водорода. Главному квантовому числу 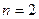 соответствуют состояния
соответствуют состояния 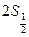 ,
, 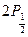 и
и  . Поскольку энергия не зависит от орбитального числа
. Поскольку энергия не зависит от орбитального числа  , первым двум состояниям соответствует одна и та же энергия. Таким образом, при
, первым двум состояниям соответствует одна и та же энергия. Таким образом, при 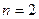 получаются два энергетических уровня, один из которых слившийся. При
получаются два энергетических уровня, один из которых слившийся. При  число различных уровней равно трем, причем один уровень
число различных уровней равно трем, причем один уровень  - простой, а два уровня
- простой, а два уровня  и
и 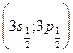 , слившиеся (рис.7.7)
, слившиеся (рис.7.7)
Рис. 7.7.
Линия  возникает при квантовых переходах с верхних уровней
возникает при квантовых переходах с верхних уровней 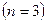 на нижние
на нижние  . Таким образом, линия
. Таким образом, линия  , а также все остальные линии серии Бальмера
, а также все остальные линии серии Бальмера  ,
,  ,
, 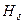 , … состоят из пяти компонент.
, … состоят из пяти компонент.
 Полный магнитный момент атома. Множитель Ланде.
Полный магнитный момент атома. Множитель Ланде.
Полный магнитный момент атома 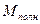 равен векторной сумме полного орбитального магнитного момента атома
равен векторной сумме полного орбитального магнитного момента атома  и полного спинового магнитного момента, причем, как было показано ранее
и полного спинового магнитного момента, причем, как было показано ранее
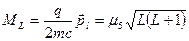 , где
, где  -полный орбитальный момент атома.
-полный орбитальный момент атома.
 , где
, где  - полный магнитный момент атома.
- полный магнитный момент атома.
 магнитный момент атома
магнитный момент атома
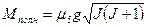
-где  - называется множителем Ланде.
- называется множителем Ланде.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2660; Нарушение авторских прав?; Мы поможем в написании вашей работы!