
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Векторная модель дипольного момента молекулы
|
|
|
|
Из лекций Кузина Э.Л.
На примере электронной энергии молекулы уже анализировалась классическая формула
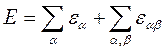 , (7.4.1)
, (7.4.1)
где 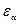 - энергия эффективного атома с номером α, а
- энергия эффективного атома с номером α, а 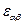 - энергия парных взаимодействий атомов участвующих в химических связях. Некорректность этой формулы нами обсуждалась (см..раздел …). Но при решении структурных задач используется похожий подход, предложенный Дж.Дж. Томсоном. Согласно этому подходу вычисление вектора дипольного момента молекулы выполняется путём векторного сложения дипольных моментов
- энергия парных взаимодействий атомов участвующих в химических связях. Некорректность этой формулы нами обсуждалась (см..раздел …). Но при решении структурных задач используется похожий подход, предложенный Дж.Дж. Томсоном. Согласно этому подходу вычисление вектора дипольного момента молекулы выполняется путём векторного сложения дипольных моментов  связей атомов с номерами α и β, найденных эмпирически:
связей атомов с номерами α и β, найденных эмпирически:
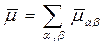 (7.4.2)
(7.4.2)
Проанализировав результаты распределения остаточных электронных зарядов молекулы формальдегида, представленных на рис. 7.6., можно сразу сказать, что выражение (7.4.2) некорректно (неоднозначно). Действительно, электрические заряды в молекуле формальдегида распределены неравномерно, то есть так, что суммарный электронный заряд на любой из σ- связей молекулы неравен нулю. Это значит, что дипольный момент связи  неинвариантен относительно выбора системы координат; таким свойством обладает только дипольный момент
неинвариантен относительно выбора системы координат; таким свойством обладает только дипольный момент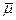 всей молекулы, которая электрически нейтральна.
всей молекулы, которая электрически нейтральна.
Приведём в качестве примеров дипольные моменты некоторых молекул и их комплексов (табл. 7.1)
Таблица 7.1
Брутто формулы молекул, их комплексы и дипольные моменты
| Молекула | μ, Д | Молекула | μ, Д | Комплекс | μ, Д |
| SnCl4 0 | (C2H5)2O C6H5CN | 1,1 3,9 | SnCl4·(C2H5)2O SnCl4· C6H5CN | 3,6 6,7 |
Но для молекул с небольшими дипольными моментами, результаты расчётов, полученные на основе модели (7.4.2) оказываются приемлемыми.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 682; Нарушение авторских прав?; Мы поможем в написании вашей работы!