
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема лекции: Комплексонометрия
|
|
|
|
План лекции:
1. Сущность метода комплексонометрии
2. Индикаторы метода
3. Преимущества метода комплексонометрии
4. Применение метода комплексонометрии в технохимическом контроле пищевых производств.
Комплексонометрия входит в группу методов титриметрического анализа, в основе которых лежат реакции комплексообразования. Эта группа методов объединяется под общим названием комплексонометрия.
Особенностью комплексонометрии является то, что в качестве основных титрантов в ней используются специфические вещества - комплексоны, образующие с определяемыми реагентами (катионами металлов) так называемые хелатные (внутрикомплексные) соединения. Комплексоны – это вещества, относящиеся к группе аминополикарбоновых кислот.
Хотя число комплексонов в настоящее время составляет не одну сотню, под термином «комплексонометрия» («хелатометрия») обычно подразумевают титрование солями этилендиаминтетрауксусной кислоты, чаще всего двузамещенной натриевой солью Na2H2Y • 2Н20, широко известной под названием комплексон III, трилон Б. Структурно-графическая формула этого соединения:

 NaOOC - H2C CH2 - COONa
NaOOC - H2C CH2 - COONa

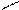 N-CH2-CH2-N
N-CH2-CH2-N
HOOC-H2C CH2-COOH
Таким образом, основным рабочим раствором комплексонометрии является Na2H2Y • 2Н20. Эта соль легко получается в чистом виде, хорошо растворима в воде, растворы устойчивы при хранении. В обычных условиях препарат содержит примерно 0,3 % влаги, поэтому титрованные растворы ЭДТА можно приготовить по точной навеске (с учетом 0,3 % Н20). Применяемые для титрования растворы ЭДТА имеют концентрацию 0,01-0,05 моль/л и реже – 0,1 моль/л.
Наиболее ценным свойством ЭДТА как титранта является его способность реагировать с ионами металлов в соотношении 1:1 независимо от заряда катиона. Эти реакции могут быть записаны в виде:
Ме2+ + H2Y2- ↔ MeY2- + 2Н+;
МеЗ+ + H2Y2- ↔ MeY2- + 2Н+;
Ме4+ + H2Y2- ↔ MeY2- + 2Н+,
где H2Y2- - анион двузамещенной соли ЭДТА.
В какой-то мере все катионы реагируют с ЭДТА, за исключением катионов щелочных металлов. Высокая устойчивость комплексов обусловлена наличием в молекуле ЭДТА нескольких донорных групп.
Упрощенная схема взаимодействия ЭДТА с ионом, двухвалентного металла, например Са2+ с образованием хелатного соединения может выглядеть так:
Na2H2Y2 +Ca2+ ↔ Na2CaY + 2H +
При взаимодействии иона металла и ЭДТА в процессе титрования происходит выделение ионов водорода. Учитывая обратимость этого взаимодействия, полноту протекания реакции увеличивают при повышении рН раствора, что достигается введением в раствор аммиачного буфера или щелочи. В некоторых случаях, однако, при повышении рН может образовываться гидроксид металла. Поэтому при работе с комплексоном добиваются оптимального значения рН раствора, зависящего от прочности комплекса и растворимости соответствующего гидроксида. Например, ион Fe3+ образует очень прочный комплекс с трилоном Б и очень труднорастворимый гидроксид. Реакция комплексообразования может протекать при рН не выше 3. Катион кальция, наоборот, образует сравнительно хорошо растворимый гидроксид и малоустойчивый комплекс, реакция с комплексоном возможна при рН 9 - 10.
Указанные выше свойства комплексонов широко используют для комплексонометрического титрования многих катионов и анионов (косвенным методом). Для этого применяют метод прямого и обратного титрования и др.
Метод прямого титрования. Титрование ведут при определенном значении рН стандартным (рабочим) раствором ЭДТА. Точку эквивалентности устанавливают с помощью индикаторов: мурексида, кислотного хрома черного, эриохрома черного Т и др. Эти индикаторы представляют собой органические красители, образующие с катионами окрашенные комплексные соединения (металл-индикаторы).
При титровании комплексоном такого окрашенного комплексного соединения оно постепенно разлагается вследствие образования нового более прочного внутрикомплексного соединения катиона с комплексоном. В точке эквивалентности первоначальный цвет комплексного соединения, образуемого индикатором с определяемым катионом, исчезает и появляется окраска, свойственная свободному индикатору.
Метод обратного титрования. К анализируемому раствору прибавляют измеренный объем стандартного раствора ЭДТА, избыток которого оттитровывают стандартным раствором соли цинка в присутствии металл-индикатора, реагирующего с ионами цинка.
Комплексонометрические индикаторы.
Некоторые органические красители образуют с катионами металлов окрашенные комплексы с гораздо меньшими значениями рК, т. е. гораздо менее стойкие, чем комплексы, образующиеся с комплексонами, из которых готовят рабочие растворы в комплексонометрии. Такие окрашенные соединения, образующие с определяемыми ионами металлов малоустойчивые комплексы, используют в качестве комплексонометрических индикаторов. Окраска комплексного соединения индикатора отличается от окраски свободного индикатора. Поэтому в процессе титрования комплексное соединение индикатора с катионом металла разрушается и индикатор выделяется в свободном виде, при этом происходит изменение окраски титруемого раствора, особенно заметное в точке эквивалентности. Схематически это можно представить следующим образом
до титрования
Kt2+ + 2HInd —► Ktlnd2 + 2H+
бес- синий красный
цветный
во время титрования и в точке эквивалентности
KtInd2 + H2Y2- ↔ KtY2- + 2HInd
красный бес- бес- синий
цветный цветный
В качестве индикаторов в комплексонометрии применяют мурексид, эриохром черный Т (хромоген специальный ЕТОО), кислотный хром темно-синий и некоторые другие.
М у р е к с и д NH4 (C8O6H5N5) • Н20 — аммонийная соль пурпуровой кислоты представляет собой порошок темно-красного цвета, плохо растворимый в воде, его 0,05%-ный раствор окрашен в фиолетово-красный цвет. С катионами многих металлов мурексид образует очень нестойкие комплексы красного или желтого цвета.
Водный раствор мурексида неустойчив, поэтому для работы приготовляют сухую смесь индикатора с NaCl в отношении 1: 100, которую и прибавляют в титровальную колбу в количестве 20— 30 мг.
Анион мурексида окрашен в фиолетовый, а образуемый им с катионом металла комплекс — в красный цвет.
Э р и о х р о м ч е р н ы й Т — диазокраситель, обладающий свойствами кислотно-основного индикатора, с точками перехода при рН=6,3 из неярко-красного в синий и при рН = 11,5 из синего в оранжевый. Индикатор окрашен в синий цвет. Окраска комплекса с ионами металлов красная.
Эриохром черный Т растворим в спирте, но растворы неустойчивы. Удобнее пользоваться сухой смесью с NaCl, приготовленной в соотношении 1: 200.
Кислотный х р о м т е м н о - с и н и й C16H1009N2S2Na2 — органический краситель. Этот индикатор по своим свойствам и окраске комплексов похож на эриохром черный Т, но более чувствителен. Хорошо растворяется в спирте и ограниченно — в воде. Растворы устойчивы, что позволяет использовать их для работы, не прибегая к сухим смесям.
Преимущества комплексонометрического метода.
Введение комплексонов в аналитическую практику расширило возможности химического анализа вообще и объемного метода в частности.
Как было указано ранее, объемно-аналитические методы анализа отличаются простотой и скоростью, что имеет решающее значение в практике промышленных лабораторий. Но до введения комплексонов объемно-аналитическими методами можно было определять лишь ограниченное число металлов. Комплексоны же позволяют определять объемными методами почти все металлы. Только ЭДТА образует комплексы с 44 катионами, из которых только Ag+ Hg2+, Ва2+ и катионы щелочных металлов обычно комплексонометрически не определяются (ртуть можно определять методом обратного титрования).
Большим достоинством комплексонов является то, что в ряде случаев представляется возможность титровать одни катионы в присутствии других, не прибегая к предварительному их разделению.
Комплексоны, являясь кислотами или их кислыми солями, при взаимодействии с катионами независимо от их степени окисления образуют ионы водорода, например:
Са2++ H2Y2- → CaY2- + 2H+
Поэтому титрование комплексонами можно проводить по методу нейтрализации, пользуясь кислотно-основными индикаторами.
Комплексонометрический метод используется для определения жесткости воды. Присутствие в воде растворимых солей кальция и магния определяет ее жесткость. Жесткая вода обладает рядом отрицательных свойств: дает осадки в виде накипи в котлах, снижает моющую способность мыл, ухудшает развариваемость отдельных продуктов и т. п. Различают временную, устранимую, или карбонатную, жесткость, обусловленную присутствием бикарбонатов Ca(HС03)2 и Mg(HCO;3)2, и постоянную, или неустранимую, жесткость, связанную с содержанием хлоридов и сульфатов кальция и магния. Сумма временной и постоянной жесткости определяет ее общую жесткость.
Жесткость воды определяют по содержанию в ней солей кальция и магия и выражают числом миллиграмм-эквивалентов их в 1 л воды (1 мг-экв = 1/1000 г-экв). Мягкая вода содержит доли миллиграмм-эквивалента, а жесткая — десятки миллиграмм-эквивалентов указанных солей. Для проведения многих технологических процессов требуется мягкая вода, поэтому необходимо определять жесткость воды. Это определение можно сделать методом нейтрализации, например титрованием 100 мл воды 0,1 н. НСl, используя качестве индикатора метиловый оранжевый. В последнее время для определения жесткости воды стали использовать комплексонометрию, так как этот метод обладает высокой чувствительностью, требует небольших затрат времени и дает хорошие результаты.
Литература:
1. Панкратова Г.В., Жванко Ю.Н., Мамедова З.И. Аналитическая химия и технохимический контроль в общественном питании. – М.: Высшая школа, 1980. – с.114 – 119.
2. Шапиро С.А., Шапиро М.А. Аналитическая химия. – М.: Высшая школа, 1979. – с. 277 – 281.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 13509; Нарушение авторских прав?; Мы поможем в написании вашей работы!