
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Развернутый план лекций
|
|
|
|
Дисциплина: «Химическая термодинамика»
Специальность: 240502 «Технология переработки пластических масс и эластомеров»
(2 курс)
Лекция 1 (1 час)
Введение
План лекции: Определение дисциплины и ее разделы. Основные понятия и определения химической термодинамики: система; среда; изолированная, термоизолированная, открытая и закрытая системы; гомогенная и гетерогенная системы; состояние системы; термодинамическое состояние системы; термодинамические параметры; термодинамический процесс; экстенсивные и интенсивные параметры; круговые (циклические) процессы; равновесные и неравновесные, обратимые и необратимые процессы.
Термодинамика изучает законы взаимных превращений различных видов энергии, связанных с переходами энергии между телами в форме теплоты и работы. Обычно она изучает только макроскопические системы.
Химическая термодинамика изучает изменение энергии в результате процессов в системе, приводящих к изменению её состава и физико-химических свойств.
Термодинамическая система – это любой изучаемый макроскопический материальный объект, отделённый от внешней (окружающей) среды реальной или воображаемой границей.
Типы термодинамических систем:
а) закрытая (замкнутая) система отличается постоянством общей массы, она не обменивается с внешней средой веществом. Обмен энергией в форме теплоты, излучения или работы возможен;
б) открытая система обменивается энергией и веществом с внешней средой;
в) изолированная система не обменивается энергией (теплотой или работой) и веществом с внешней средой и имеет постоянный объём;
г) адиабатически-изолированная система лишена возможности только теплообмена с внешней средой, она может быть связана с внешней средой работой получаемой от неё и совершаемой над ней.
Параметры состояния системы – это любые измеряемые макроскопические характеристики состояния системы. Различают:
-интенсивные параметры – параметры, не зависящие от массы (температура T, давление P).
-экстенсивные параметры (ёмкостные) – параметры пропорциональные массе вещества (объем V, теплоемкость C, масса m). Экстенсивные параметры станут интенсивными, если их отнести к единице массы вещества (удельный объем Vуд, плотность ρ).
Термодинамический процесс – это всякое изменение в системе, связанное с изменением хотя бы одного из термодинамических параметров. Изменение вследствие химического превращения называется химической реакцией.
Виды процессов:
1. T=const – изотермический или изотермный.
2. P=const – изобарный или изобарический.
3. V=const – изохорный или изохорический.
4. Q=const – адиабатический или адиабатный.
Функция состояния системы – это параметр, изменение которого зависит только от начального и конечного состояния системы и не зависит от пути процесса(внутренняя энергия U, энтальпия H, энергия Гиббса G, энергия Гельмгольца F, энтропия S, химический потенциал μ).
Равновесное состояние системы – это состояние при котором термодинамические параметры не изменяются со временем и сохраняют одинаковые значения в каждой фазе; при этом энергия системы минимальна.
Неравновесное состояние системы – это состояние, при котором термодинамические параметры изменяются со временем.
Круговым (циклическим) процессом или циклом называется процесс, в течение которого система изменяла свои свойства и в конце которого вернулась к исходному состоянию.
Обратимый процесс – это идеальное понятие. Он протекает как в прямом так и в обратном направлении без изменения работоспособности системы. Обратимый процесс протекает бесконечно медленно через одну и ту же последовательность состояния равновесия в обоих направлениях, чтобы после возвращения системы в первоначальное состояние ни в окружающей среде, ни в самой системе не было никаких изменений. В обратимых процессах совершается максимальная работа.
При необратимых процессах возвращение системы в исходное состояние связано с изменением состояния внешней среды. Поэтому затрата работы на обратный процесс (возвращение в исходное состояние) значительно больше работы прямого процесса: Aобратн. >>Aпрям..
Лекция (2 часа)
Первый закон термодинамики
План лекции: Функция состояния и функция процесса. Формулировка первого закона термодинамики. Принцип эквивалентности работы и энергии. Первый закон как отражение законов сохранения и превращения энергии и вещества. Математическое выражение первого закона. Термодинамическое определение внутренней энергии, теплоты и работы, их расчет в простейших термодинамических процессах. Энтальпия. Тепловые эффекты в процессах, протекающих при постоянных давлении, объеме. Теплоемкость, теплоемкости при постоянном давлении и постоянном объеме, связь между ними, уравнение Майера. Температурная зависимость теплоемкости.
Внутренняя энергия U – это общий запас энергии системы, который складывается из энергии движения и взаимодействия молекул, ядер и электронов в атомах, т. е. всех видов энергии системы кроме кинетической энергии системы как целого и её потенциальной энергии положения. Абсолютную величину U определить невозможно, можно определить только её изменение ∆U. Внутренняя энергия зависит от природы вещества, Т, Р, агрегатного состояния и др. U – это функция состояния системы.
Другая функция состояния системы - это энтальпия Н. H=U + pV, где p∆V – работа расширения. Энтальпию называют энергией расширенной системы или теплосодержанием системы. Абсолютное значение H определить невозможно.
Для описания процессов протекающих при V=const используется ∆U. Для описания процессов протекающих при P=const используется ∆H. Разница между ∆U и ∆H значительна для систем, содержащих вещества в газообразном состоянии. Для конденсированных, особенно кристаллических состояний разница между ∆U и ∆H относительно невелика.
Теплота и работа – это формы передачи энергии, величины которых характеризуют процесс и зависят от пути процесса; они функции процесса.
Теплота Q – это неупорядоченная форма передачи энергии. Она всегда связана с тепловым (хаотическим) движением частиц. Теплота считается положительной, Q>0, если тепло поглощается системой (эндотермический процесс). Теплота отрицательна, Q< 0, если тепло выделяется системой (экзотермический процесс).
Если тепловой эффект химической реакции процесса  , то ∆Q>0 ←
, то ∆Q>0 ←  < 0 (эндо), ∆Q>0 →
< 0 (эндо), ∆Q>0 →  < 0 (экзо).
< 0 (экзо).
То есть  , теплота и тепловой эффект отличаются по знаку.
, теплота и тепловой эффект отличаются по знаку.
Работа А – это упорядоченная форма передачи энергии. Работа считается положительной A >0, если она совершается системой против внешних сил (например, расширение газа), и работа отрицательна A <0, если она производится внешними силами над системой (например, сжатие газа). Работа представляет сумму 
здесь  - это полезная работа (работа против гравитационных, электрических и других сил, несвязанных с изменением термодинамических параметров);
- это полезная работа (работа против гравитационных, электрических и других сил, несвязанных с изменением термодинамических параметров);  - работа по преодолению внешнего давления, необходимая для удержания системы в состоянии механического равновесия или работа расширения. Для многих систем она единственный вид работы, поэтому
- работа по преодолению внешнего давления, необходимая для удержания системы в состоянии механического равновесия или работа расширения. Для многих систем она единственный вид работы, поэтому  =0 и A=p∆V.
=0 и A=p∆V.
 , тогда
, тогда  ,
,
здесь d – мгновенное изменение, δ – бесконечно малая величина.
Первый закон термодинамики – это постулат. Известны следующие формулировки закона.
1. закон сохранения энергии в применении его к термодинамическим процессам; является Одним из выражений первого закона термодинамики: в изолированной системе общий запас энергии сохраняется постоянным.
2. Энергия переходит из одного вида (формы) в другой в строго эквивалентных количествах.
3. Вечный двигатель первого рода невозможен: получить работу не затрачивая энергию нельзя.
Пусть система переходит из состояния 1 в состояние 2. При этом система поглощает теплоту Q, которая расходуется на изменение внутренней энергии системы ∆U и совершения работы А.
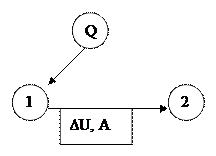 Q = ∆U + A, или
Q = ∆U + A, или  Q = dU +
Q = dU +  A.
A.
Это математическое выражение 1-го закона термодинамики.
Термохимия – это раздел термодинамики, который изучает тепловые эффекты процессов. Тепловой эффект  – это теплота, которая выделяется или поглощается в результате процесса, протекающего при постоянном Р или V, причём температура исходных веществ и продуктов реакции одинакова, а полезная работа равна нулю
– это теплота, которая выделяется или поглощается в результате процесса, протекающего при постоянном Р или V, причём температура исходных веществ и продуктов реакции одинакова, а полезная работа равна нулю  = 0.
= 0.
Рассмотрим изохорный процесс (V=const).

Если V=const, то dV =0, тогда pdV =0 и, следовательно,
 или
или 
Тепловой эффект реакции при изохорном процессе равен изменению внутренней энергии системы.
Рассмотрим изобарный процесс (р=const).
 или
или  , или
, или

Так как  - это энтальпия системы, тогда
- это энтальпия системы, тогда
 или
или  и
и 
в изобарном процессе Тепловой эффект реакции равен изменению энтальпии.
Заменим выражение  на выражение
на выражение  Согласно уравнению Клайперона-Менделева
Согласно уравнению Клайперона-Менделева  , тогда
, тогда

где  - изменение числа молей газообразных веществ, участвующих в реакции.
- изменение числа молей газообразных веществ, участвующих в реакции.
Для конденсированных систем QР=QV.
Теплоёмкость – это количество тепла, необходимое для нагревания данного количества вещества на один градус. Удельная и молярная теплоёмкость – это отношение количества теплоты Q, поглощённое 1граммом (Суд - удельная) или 1 молем (См - молярная) вещества к повышению температуры (∆T=T2 – T1), которым сопровождается его нагревание.
Единицы измерения теплоемкости: [Cуд] = Дж/г К, [Cм] = Дж/моль
К, [Cм] = Дж/моль К.
К.
Средняя теплоемкость  определяется как
определяется как

Истинная теплоемкость определяется как

При Р=const,  ; при V=const,
; при V=const,  .
.
Разница между теплоемкостью при изобарных и при изохорных условиях равна газовой постоянной R (CР – CV =R). (2) зависит (1)Теплоемкость от температуры. Зависимость C=f(T) выражается эмпирическими уравнениями, найденными опытным путём. Они имеют вид:
 или
или  ,
,
где  - коэффициенты, получаемые после обработки экспериментальных данных; они приведены в справочниках.
- коэффициенты, получаемые после обработки экспериментальных данных; они приведены в справочниках.
Лекция 3 (3 часа)
Термохимия
План лекции: Термохимия. Закон Гесса. Основные следствия закона Гесса и использование их для расчета тепловых эффектов физико-химических процессов. Зависимость теплового эффекта от теплоемкости и температуры. Уравнение Кирхгофа. Развернутое уравнение Кирхгофа.
Закон Гесса – это основной закон термохимии. Формулировка закона: тепловой эффект процесса не зависит от числа и характера промежуточных стадий, а определяется только начальным и конечным состоянием системы.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1030; Нарушение авторских прав?; Мы поможем в написании вашей работы!