
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример. Рассмотрим реакцию
C(графит) + O2(газ) → CO2(газ); тепловой эффект реакции равен ∆H1.
Запишем реакцию через промежуточные стадии.
C(графит) + 0,5O2(газ) = CO(газ), ∆H2 ; (1)
CO(газ) + 0,5O2(газ) = CO2(газ), ∆H3; (2)
Просуммируем реакции (1) и (2):
C(графит) + O2(газ) → CO2(газ).
Получаем исходную реакцию, поэтому сумма тепловых эффектов реакций (1) и (2) равна тепловому эффекту исходной реакции: ∆H2 + ∆H3 = ∆H1.
Условие применения закона Гесса: закон применим только к тепловым эффектам процесса,т.е. к условиям, когда процесс протекает при Р=const или V=const, а полезная работа равна нулю  = 0, температура продуктов реакции равна температуре исходных веществ. Закон применим не только к химическим реакциям, но и к любым другим физико-химическим процессам.
= 0, температура продуктов реакции равна температуре исходных веществ. Закон применим не только к химическим реакциям, но и к любым другим физико-химическим процессам.
Пример: ∆H возгонки = ∆H плвл + ∆H испар.
Термодинамическое обоснование закона Гесса заключается в следующем. Установлено, что QV = ∆U, а QP = ∆Н. Так как внутренняя энергия U и энтальпия H являются функциями состояния системы, т. е. не зависят от пути процесса, то QV и QP не будут зависеть от промежуточных стадий, а определяются только начальным и конечным состоянием системы.
Практическое значение закона Гесса заключается в следующем. Закон позволяет рассчитывать тепловые эффекты процессов не проводя экспериментов; тепловые эффекты неосуществимых процессов и процессов, для которых тепловой эффект нельзя определить опытным путём.
Уравнение химической реакции с указанием теплового эффекта называется термохимическим уравнением. С термохимическими уравнениями можно обращаться также, как и с алгебраическими уравнениями (складывать, умножать, делить).
Первое следствие из закона Гесса: тепловой эффект обратной реакции равен по величине и противоположен по знаку тепловому эффекту прямой реакции.
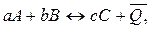
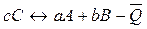 .
.
Второе следствие из закона Гесса: тепловой эффект реакции равен сумме теплот (энтальпий) образований продуктов реакций за вычетом (минус) суммы теплот (энтальпий) образования исходных веществ.
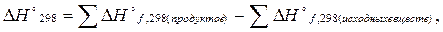
здесь индекс f от лат. foramentum – образование.
Например для реакции aA + bB→cC + dD,
∆Hº 298 = (с∆Hºf, 298 (C) + d∆Hºf, 298 (D)) – (a∆Hºf, 298 (A) + b∆Hºf, 298 (B)).
При суммировании обязательно учитываются стехиометрические коэффициенты уравнения реакции. Для расчета тепловых эффектов используются стандартные теплоты образования веществ. Стандартной теплотой (энтальпией) образования вещества (  или
или  ) называется изменение энтальпии при образовании 1-го моля вещества из простых веществ, находящихся при стандартных условиях. Стандартная энтальпия простого вещества равна нулю.
) называется изменение энтальпии при образовании 1-го моля вещества из простых веществ, находящихся при стандартных условиях. Стандартная энтальпия простого вещества равна нулю.
Например, если вещество получено по реакции выраженной термохимическим уравнением
Ca(тв.) + C(графит) + 1,5O2(газ) = CaCO3(тв.) + 1207,7 Дж/моль,
его стандартная теплота образования равна
∆Hºf,298 (CaCO3)= - 1207,7 Дж/моль.
Третье следствие из закона Гесса: тепловой эффект реакции равен сумме теплот сгорания исходных веществ за вычетом (минус) суммы теплот сгорания продуктов реакции.
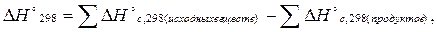
здесь индекс с от лат. combustum - сгорание.
Например для реакции aA + bB→cC + dD,
∆H298 = a∆Hºс,298(A) + b∆Hºс,298(B) - c∆Hºс,298(C) - d∆Hºс,298(D)
Стандартная теплота сгорания вещества (∆Hºс,298, ∆Hºсгор. ) – это убыль энтальпии в реакции сгорания 1-го моля простого вещества или соединения, до соответствующих окисленных форм элементов. В случае сгорания соединений, состоящих из углерода и водорода (например, топливо) до CO2 и H2O. Стандартные теплоты сгорания и образования приведены в справочных таблицах термодинамических величин.
Закон Кирхгоффа устанавливает зависимость теплового эффекта реакции от температуры. Формулировка закона: температурный коэффициент теплового эффекта реакции равен изменению теплоемкости в результате процесса.
При изобарных условиях (Р=const)
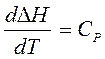 , где
, где 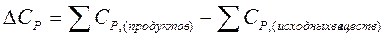 .
.
В зависимости от знака ∆CР тепловой эффект реакции (процесса) с ростом температуры может увеличиваться или уменьшаться.
1) Если ∆Cp >0, то с ростом температуры ∆H увеличивается.
2) Если ∆Cp <0, то с ростом температуры ∆H уменьшается
3) Если ∆Cp = 0, то тепловой эффект не зависит от температуры.
Проинтегрируем уравнение Кирхгоффа d∆H = ∆CРdT.
1. Пусть теплоемкость СР не зависит от температуры, т.е. ∆СР = const, что допустимо в небольшом интервале температур. Тогда
 . Отсюда выведем
. Отсюда выведем
формулу для вычисления теплового эффекта:
∆H2 =∆H1 + ∆CР(T2 – T1).
2. Пусть теплоемкость ∆CР – является функцией от температуры, т.е. ∆Cp= f(T). Эта зависимость выражается уравнениями Cp = a + bT + cT² или Cp = a + bT + 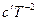 . В общем виде изменение теплоемкости равно
. В общем виде изменение теплоемкости равно
∆Cp = ∆a + ∆bT + ∆cT² +  . Подставим это выражение в уравнение Кирхгоффа, тогда
. Подставим это выражение в уравнение Кирхгоффа, тогда
d∆HT = (∆aT + ∆bT + ∆cT² + 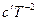 )dT.
)dT.
Возьмем неопределённый интеграл и получим выражение
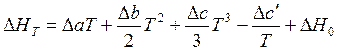 .
.
Это уравнение показывает зависимость теплового эффекта реакции от температуры. В нем ∆H0 – (2) определяемая как значение теплового эффекта при одной из температур.(1) постоянная интегрирования,
Закон Кирхгоффа для изохорного процесса (V=const) математически выражается как 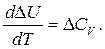
Лекция 4 (3 часа)
Второй закон термодинамики
План лекции: Второй закон термодинамики, его формулировки. Самопроизвольные (спонтанные) и несамопроизвольные процессы. Аналитическое выражение второго закона термодинамики и его обоснование с использованием цикла Карно. Энтропия. Объединенное уравнение первого и второго законов термодинамики. Расчет изменения энтропии в простейших термодинамических процессах - адиабатическом, изотермическом, изохорическом и изобарическом. Абсолютное значение энтропии. Постулат Планка. Изменение энтропии при фазовых переходах. Использование энтропии для определения направления протекания самопроизвольных процессов в изолированных системах.
Самопроизвольные процессы описываются следующими характеристиками.
1. Все природные самопроизвольные процессы протекают в одном направлении, т. е. имеют одностороннее направление. Например, тепло от горячего тела переходит к холодному; газы стремятся занять наибольший объём.
2. Часть энергии переходит в теплоту, т. е. система из упорядоченного состояния переходит в состояние с беспорядочным тепловым движением частиц.
3. Самопроизвольные процессы можно использовать для получения полезной работы. По мере превращения система теряет способность производить работу. В конечном состоянии равновесия она имеет наименьший запас энергии.
4. Систему нельзя вернуть в исходное состояние, не производя каких-либо изменений в ней самой или в окружающей среде. Все самопроизвольные процессы термодинамически необратимы.
5. В самопроизвольном процессе начальное состояние является менее вероятным по сравнению с каждым последующим и наименее вероятным по сравнению с конечным.
Термодинамическая вероятность характеризует ту или иную степень беспорядка в сообществе частиц, из которых состоят тела системы. Термодинамическая вероятность, или вероятность состояния системы, оценивается энтропией. Энтропия S – это особая функция состояния системы, связанная с теплотой:
 ,
,
где W - термодинамическая вероятность, определяемая как число микросостояний присущих данному макросостоянию; k – постоянная Больцмана; 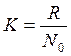 , здесь N0 – число Авогадро, равное 6,02 * 1023.
, здесь N0 – число Авогадро, равное 6,02 * 1023.
Несамопроизвольные процессы протекают при затрате работы; при этом система удаляется от состояния равновесия (например, сжатие газа, электролиз).
Второй закон термодинамики – это постулат. Он имеет статистический характер и применим к системам из большого числа частиц. Второй закон термодинамики имеет следующие формулировки.
1. Теплота не может переходить самопроизвольно от менее нагретого тела к более нагретому.
2. Невозможен процесс, единственным результатом которого является превращение теплоты в работу.
3. Вечный двигатель второго рода невозможен.
Второй закон термодинамики выражается математически через изменение энтропии обратимого процесса следующим образом:
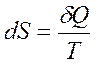 ,
,
где S – энтропия, это такая функция состояния системы, полный дифференциал которой в обратимом процессе равен отношению бесконечно малого количества теплоты к температуре.
Изменение энтропии в обратимом процессе равно изменению энтропии в необратимом процессе, т.е. 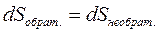 . Сравним теплоты обратимого и необратимого процессов. Согласно первому закону термодинамики
. Сравним теплоты обратимого и необратимого процессов. Согласно первому закону термодинамики 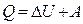 . Внутренняя энергия U – это функция состояния системы, поэтому
. Внутренняя энергия U – это функция состояния системы, поэтому 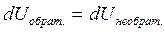 . Максимальная работа совершается при обратимом процессе, поэтому
. Максимальная работа совершается при обратимом процессе, поэтому 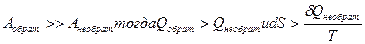 . В общем случае для обратимого и необратимого процессов выражение второго закона термодинамики имеет следующее математическое выражение:
. В общем случае для обратимого и необратимого процессов выражение второго закона термодинамики имеет следующее математическое выражение:
 .
.
Здесь dS = const, а изменяется только правая часть уравнения, т.е. значение величины теплоты. Единицы измерения энтропии: [S] = Дж/моль *К.
Энтропия, как критерий возможности протекания процесса в изолированной системе (U,V=const). Изолированная система не обменивается с окружающей средой теплотой, т.е. 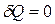 . Поэтому, согласно второго закона термодинамики (dS)U,V ≥ 0.
. Поэтому, согласно второго закона термодинамики (dS)U,V ≥ 0.
Необратимый процесс в изолированной системе возможен при
(dS)U,V >0. При равновесном состоянии системы (или обратимом процессе) (dS)U,V = 0; при этом энтропия принимает максимальное значение S=Smax. Если (dS)U,V < 0 – необратимый процесс в изолированной системе неосуществим.
Рассмотрим вычисление изменения энтропии в различных процессах.
1. Изменение энтропии 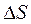 при фазовых переходах (T=const) определяется по формуле
при фазовых переходах (T=const) определяется по формуле
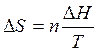 ,
,
где ∆H - теплота фазового перехода (кипение, испарение, возгонка, плавление); n – число молей вещества, переходящего из одной фазы в другую; n=g/M, где g – масса вещества, M – его молярная масса.
2. Изменение энтропии ∆S при нагревании.
а) Пусть p=const, тогда
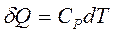 ,
, 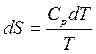 .
.
Если CР=const, тогда ∆S = CР * ln ,
,
где Т1 и Т2 – температуры начала и окончания нагревания вещества.
Пусть [ CР ] выражается в Дж/моль*К, тогда ∆S = n * CР * ln ,
,
Пусть Cp выражается в Дж/г*К, тогда ∆S = CР * g * ln .
.
Если Cp зависит от температуры, т.е. CР = f(T), тогда
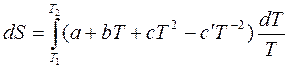 .
.
б) Пусть V= const, тогда  .
.
3. Измерение стандартной энтропии системы  при протекании химической реакции определяется как разность суммы стандартных энтропий продуктов и суммы стандартных энтропий исходных веществ.
при протекании химической реакции определяется как разность суммы стандартных энтропий продуктов и суммы стандартных энтропий исходных веществ.
 .
.
Значение величин стандартных энтропий веществ приведены в справочниках.
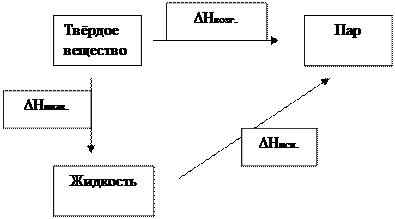
Постулат Планка имеет следующую формулировку: при абсолютном нуле энтропия правильно образованных кристаллов чистых веществ равна нулю. Постулат позволяет рассчитать абсолютное значение энтропии, если известны теплоты фазовых переходов, и если известны теплоёмкости вещества в различных агрегатных состояниях. Для расчёта абсолютного значения S вещество нагревается от абсолютного нуля до данной температуры.
Для твёрдого тела при температуре T
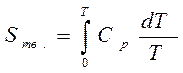 .
.
Для жидкости при температуре T

Для газа при температуре T
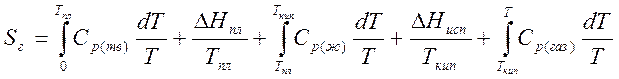
|
Дата добавления: 2014-01-07; Просмотров: 1128; Нарушение авторских прав?; Мы поможем в написании вашей работы!