
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 5. Термодинамика агрегатных превращений
Термодинамика агрегатных превращений
План лекции: Термодинамика агрегатных превращений. Уравнение Клайперона – Клаузиуса. Зависимость давления насыщенного пара от температуры.
Лекция 6 (4 часа)
Термодинамические потенциалы
План лекции: Термодинамические потенциалы. Изохорно-изотермический потенциал или свободная энергия Гельмгольца. Изобарно-изотермический потенциал или свободная энергия Гиббса. Характеристические функции: внутренняя энергия, энтальпия, свободная энергия Гельмгольца, свободная энергия Гиббса. Применение энергии Гиббса и энергии Гельмгольца в качестве критериев направления самопроизвольных процессов и равновесия в неизолированных системах.
Объединенное уравнение первого и второго законов термодинамики. Уравнение Гиббса-Гельмгольца. Химический потенциал.
Термодинамический потенциал – это функция состояния системы, убыль которой в процессе, протекающем при постоянстве двух параметров, равна максимальной полезной работе.
Энергия Гельмгольца как изохорно-изотермический потенциал.
Для изохорно-изотермических условий V=const, T=const. Объединенное уравнение, выражающее первый и второй законы термодинамики, имеет следующий вид: 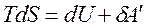 .
.
Так как при V=const,  =0, получим
=0, получим 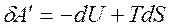 .
.
Проинтегрируем данное уравнение: 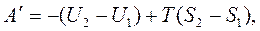
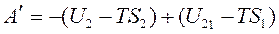 .
.
Введем обозначение F=U+TS – это энергия Гельмгольца. Тогда
F2=U2 -TS2, и F1=U1- TS1.  ,
, 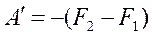 или
или 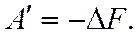
То есть энергия Гельмгольца – это термодинамический потенциал, так как его изменение равно полезной работе при протекании обратимого процесса в системе. Для необратимого процесса: 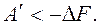 В общем случае для обратимого и необратимого процессов справедливо выражение
В общем случае для обратимого и необратимого процессов справедливо выражение

Энергия Гельмгольца как критерий возможности протекания процесса. Энергия Гельмгольца равна 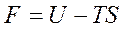 , отсюда U=F+TS. То есть F – это та часть внутренней энергии, которая может быть превращена в работу, поэтому она называется свободной энергией; произведение TS – это энергия, которая выделяется в виде тепла, поэтому она называется связанной энергией.
, отсюда U=F+TS. То есть F – это та часть внутренней энергии, которая может быть превращена в работу, поэтому она называется свободной энергией; произведение TS – это энергия, которая выделяется в виде тепла, поэтому она называется связанной энергией.
Дифференцируя выражение 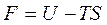 получим dF=dU–TdS -SdT. Подставляя вместо произведения TdS его выражение из «объединенного» уравнения TdS ≥dU+pdV получим dF ≤ - SdT - pdV.
получим dF=dU–TdS -SdT. Подставляя вместо произведения TdS его выражение из «объединенного» уравнения TdS ≥dU+pdV получим dF ≤ - SdT - pdV.
Так как SdT=0 и pdV=0 (при Т=cons t и V=const), тогда для изохорно-изотермических условий (dF)v,T≤ 0.
В закрытых (замкнутых) системах при изохорно-ихотермических условиях:
· если dF<0, то процесс протекает самопроизвольно;
· если dF>0, то процесс не протекает;
· если dF=0, то система находится в состоянии равновесия.
Энергия Гиббса как изобарно-изотермичесий потенциал. Для изобарно-изотермических условий р=const, T=const. Преобразуем объединенное уравнение первого и второго законов термодинамики:
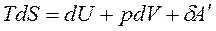 или
или 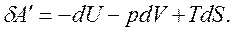
Проинтегрируем это выражение:
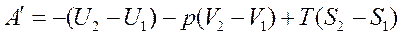 или
или  .
.
Введем обозначение 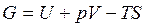 - это энергия Гиббса. Тогда
- это энергия Гиббса. Тогда 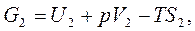
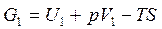 .
.
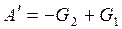 ,
, 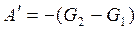 ,
, 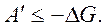 То есть энергия Гиббса G – это термодинамический потенциал, так как его изменение равно полезной работе при протекании обратимого процесса в системе. Для необратимого процесса
То есть энергия Гиббса G – это термодинамический потенциал, так как его изменение равно полезной работе при протекании обратимого процесса в системе. Для необратимого процесса  В случае для обратимого и необратимого процесса справедливо выражение
В случае для обратимого и необратимого процесса справедливо выражение 
Энергия Гиббса равна 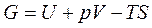 , но
, но 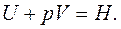 Поэтому
Поэтому 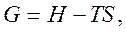 отсюда
отсюда 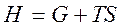 . Энергия Гиббса G – эта часть энтальпии, которая может быть превращена в работу; поэтому она называется свободной энергией.
. Энергия Гиббса G – эта часть энтальпии, которая может быть превращена в работу; поэтому она называется свободной энергией.
В выражение для энергии Гиббса 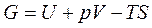 подставим энергию Гельмгольца, которая определяется как F= U - TS. Тогда получим, что
подставим энергию Гельмгольца, которая определяется как F= U - TS. Тогда получим, что 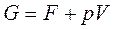 или
или 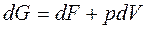 .
.
Энергия Гиббса, как критерии возможности протекания процесса.
Продифференцируем выражение 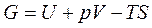 , получим
, получим
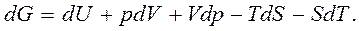
Вместо TdS подставим его значение из объединенного уравнения первого и второго законов термодинамики, 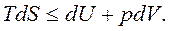 Тогда
Тогда 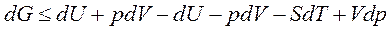 или
или 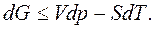
В изобарно-изотермических условиях 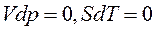 и
и 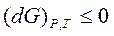 . Т.е. dG является критерием возможности протекания процесса в замкнутой (закрытой) системе в изобарно-изотермических условиях. При этом
. Т.е. dG является критерием возможности протекания процесса в замкнутой (закрытой) системе в изобарно-изотермических условиях. При этом
· если dG< 0, то процесс протекает самопроизвольно;
· если dG> 0, то процесс самопроизвольно не протекает;
· если dG= 0, то система находится в состоянии равновесия.
|
Дата добавления: 2014-01-07; Просмотров: 349; Нарушение авторских прав?; Мы поможем в написании вашей работы!