
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные понятия и определения химической термодинамики
|
|
|
|
Введение. Предмет физической химии.
Лекция 1. Первый закон термодинамики
1.1 Введение. Предмет физической химии
1.2 Основные понятия и определения химической термодинамики
1.3 Формулировки, математическое выражение первого закона
1.4 Тепловые эффекты изохорного и изобарного процессов, их взаимосвязь
Физическая химия – наука, изучающая взаимосвязь химических и физических явлений, теоретическая основа всех химических и многих естественных наук (в т.ч. биологии). Химия изучает химические вещества и их превращения. Физика – в основном энергию и ее превращения. Физическая химия – промежуточная область между химией и физикой.
В 60-х годах XIX в. Бекетов Н.Н. – основоположник российской физической химии – писал: “Знать химию и еще больше – производить химические исследования – невозможно без основательного знакомства с физикой, а потому также и с математикой ”.
Все процессы в живом организме связаны с превращением вещества и энергии – их изучает физическая химия. Основоположник отечественной физиологии Сеченов И.М. отмечал: “Физиолог – это физико-химик, имеющий дело с явлениями в животных организмах”. И.П. Павлов продолжал: “Клетка в некотором отношении похожа на физико-химическую лабораторию. Там надо ждать всех тех явлений, которые бывают при физико-химических процессах”.
Отдельные направления физической химии в XVIII – XIX вв. развивались параллельно и самостоятельно. Основой для превращения этих направлений в единую физико-химическую науку стало успешное применение законов и представлений термодинамики к химии. Как самостоятельная наука физическая химия появилась в конце XIX века благодаря работам зарубежных ученых Вант-Гоффа, Гиббса, Оствальда, Аррениуса, русских ученых Менделеева, Каблукова, Гесса, Коновалова и др.
Современный курс физической химии содержит следующие основные разделы:
1) строение вещества,
2) химическая термодинамика,
3) учение о растворах неэлектролитов и электролитов,
4) гетерогенные равновесия,
5) электрохимия,
6) химическая кинетика и катализ.
Термодинамика исторически возникла при рассмотрении превращений теплоты в механическую работу. Термодинамика – это наука, изучающая взаимопревращения теплоты, работы и различных видов энергии. Она базируется на четырех постулатах (нулевой, первый, второй и третий законы термодинамики), которые вытекают из более общих законов природы. Применение этих постулатов к химическим и фазовым превращениям составляет содержание химической термодинамики.
Термодинамика не рассматривает “внутренний мир”, т.е. атомную и молекулярную структуру вещества. Ее уравнения справедливы только для описания макроскопических свойств систем. Сопоставляя эти свойства в исходном и конечном состояниях, термодинамика количественно описывает происходящие в системе процессы. Следует отметить, что механизм и скорость протекания реакций термодинамика не рассматривает.
Остановимся на некоторых основных термодинамических понятиях и определениях.
1. Термодинамическая система – это отдельное тело или группа тел, выделяемых (реально или мысленно) для рассмотрения из окружающей среды. Все то, что не входит в термодинамическую систему, называется окружающей средой. Система должна обязательно содержать большое число молекул, так как системы с малым числом молекул в термодинамике не рассматриваются.
Изолированная система – это система, которая лишена возможности обмена и веществом, и энергией с окружающей средой.
Закрытая (замкнутая) система – система, которая в ходе химического процесса обменивается с окружающей средой только энергией (например, закрытый сосуд с химическим веществом, баллон с газом).
Открытая система – это система, которая может обмениваться с окружающей средой и веществом, и энергией (например, живой организм).
2. Термодинамические свойства системы: состояние системы характеризуется совокупностью физических и химических свойств, например объем V, температура Т, энергия Q, число молей n, а также плотность, концентрация, теплоемкость и др.
3. Параметры состояния – независимые переменные, выбираемые для однозначной характеристики термодинамической системы. Например, для характеристики газа из трех параметров (давление р, объем V, температура Т) выбирают два.
Интенсивные параметры состояния – не зависят от количества вещества (Т, р, концентрация и др.), при взаимодействии систем они выравниваются.
Экстенсивные параметры состояния – пропорциональны количеству вещества системы (V, масса, количество электричества и др.), при взаимодействии систем они суммируются.
Важнейшие параметры состояния – р, V, Т.
4. Всякое изменение параметров состояния называется термодинамическим процессом:
а) изотермический процесс, Т = const;
б) изобарный процесс, р = const;
в) изохорный процесс, V = const;
г) адиабатический процесс (Q=0), в котором нет обмена теплотой между системой и окружающей средой;
д) изобарно-изотермический процесс, р = const, Т = const;
е) изохорно-изотермический процесс, V = const, Т = const.
Круговым называется процесс, в результате которого параметры состояния системы возвращаются к своим первоначальным значениям.
Равновесным называется процесс, при котором система непрерывно проходит последовательный ряд равновесных состояний.
Обратимым называется процесс, при котором имеется возможность возвращения системы из любого промежуточного или конечного состояния в исходное таким образом, чтобы во внешней среде не осталось никаких изменений.
Все реальные процессы протекают с конечной скоростью и не являются равновесными или обратимыми.
Зачем же вводится такое понятие?

При обратимом процессе работа, совершаемая системой при переходе из начального состояния в конечное – максимальна, а работа, затрачиваемая на обратный перевод – минимальна.
Изотермический процесс расширения газа описывается формулой:
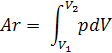
В химической термодинамике важное значение имеет внутренняя энергия.
5. Внутренняя энергия – U – характеризует общий запас энергии термодинамической системы. Включает все виды энергии движения и взаимодействия атомов, ядер, электронов, молекул.
 (1.1)
(1.1)
В её состав не входят – кинетическая энергия системы (в целом) и потенциальная энергия в поле внешних сил.
U – абсолютное значение внутренней энергии определить невозможно, однако для термодинамики это не требуется. Изменение внутренней энергии ∆U равно разности энергий в конечном и начальном соотношениях:
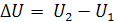 (1.2)
(1.2)
ΔU > 0, если внутренняя энергия системы возрастает. Работа А и теплота Q – это две возможные формы передачи энергии от одной системы к другой. В отличие от U теплота и работа не являются свойствами системы, т.к. передача теплоты или совершение работы осуществляется лишь при взаимодействии системы с внешней средой или другой системой. Условимся считать, что теплота Q имеет знак (+) если она получена системой от окружающей среды, знак (–), если она отдана окружающей среде. Работа (А) со знаком (+) – это работа, производимая термодинамической системой и со знаком (–) если она производится над системой. А и Q измеряются в Дж (кал), причем 1 кал = 4,184 Дж.
Если системы А и В находятся в тепловом равновесии с системой С, то можно утверждать, что они находятся в тепловом равновесии друг с другом (1931г., Фаулер, закон транзитивности теплового равновесия). Это один из основных законов природы.
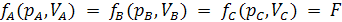
где 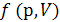 – эмпирическая температура.
– эмпирическая температура.
Нулевой закон термодинамики лежит в основе измерения температуры тел с помощью термометра. Из нулевого закона термодинамики следует, что
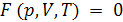
Это уравнение состояния для каждой из контактирующих систем.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1018; Нарушение авторских прав?; Мы поможем в написании вашей работы!