
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Формулировки, математическое выражение первого закона
|
|
|
|
Первый закон (начало) термодинамики – это закон сохранения и превращения энергии (ЗСПЭ) в применении к тепловым процессам, т.е. процессам, связанным с превращением теплоты в работу. ЗСПЭ, открытый Лейбницем и Ломоносовым – это универсальный закон природы, применимый к явлениям в макросистемах и системах с малым числом молекул. Первоначально был установлен в механике, затем распространен в теории электричества.
Пусть к закрытой термодинамической системе подведено некоторое количество теплоты Q, которая идет на увеличение внутренней энергии U и на совершение системой работы расширения А. Тогда первый закон может формулироваться так: в любом термодинамическом процессе приращение внутренней энергии системы ΔU = U2 – U1 равно количеству сообщаемой системе теплоты минус количество работы А, совершаемой системой:
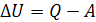 (1.3)
(1.3)
Изменение внутренней энергии ΔU не зависит от пути проведения процесса, а определяется только начальным и конечным состоянием системы.
Внутренняя энергия – это функция состояния, т.к. она удовлетворяет двум условиям:
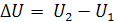

В отличие от внутренней энергии теплота и работа не являются функциями состояния системы, поскольку они зависят от пути проведения процесса. Математическая запись первого закона термодинамики в дифференциальной форме для элементарного процесса имеет вид:
 (1.4)
(1.4)
Другие формулировки первого закона термодинамики гласят:
1. В любой изолированной термодинамической системе общее количество энергии постоянно. Для изолированных термодинамических систем δQ = 0 и δA = 0, тогда dU = 0 и U = const, т.е. внутренняя энергия в изолированной системе величина постоянная.
2. Разные формы энергии переходят друг в друга в строго эквивалентных количествах.
3. Вечный двигатель первого рода невозможен.
Первый закон термодинамики был сформулирован в середине XIX в. Р. Майером и независимо от него Д. Джоулем. Гельмгольц включил в уравнение наряду с механической другие виды работ. Если в термодинамической системе имеет место только работа расширения, тогда

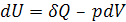

Математическое выражение первого закона термодинамики в дифференциальной форме иногда представляют так:
 (1.5)
(1.5)
Последнее выражение включает A′ – «полезную» работу, т.е. все виды работы, не связанные с изменением объема. Например, «полезная» работа за счет электрических сил, химических превращений и т.д.
Для открытых термодинамических систем математическое выражение первого закона имеет вид
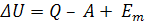
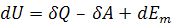 (1.6)
(1.6)
где Em – энергия, связанная с изменением массы термодинамической системы.
1.4 Тепловые эффекты изохорного и изобарного процессов, их взаимосвязь.
Химические реакции протекают с выделением или поглощением тепла, т.е. характеризуются определенным тепловым эффектом. Тепловой эффект химической реакции зависит не только от природы и количества веществ, их агрегатных состояний, степени кристалличности, но и от условий протекания процесса (Р, V, Т). Поэтому недостаточно говорить, что тепловой эффект – это количество теплоты, выделяемое (поглощаемое) при необратимом протекании реакции. Для корректности формулировки необходимо соблюдать определенные условия:
1. V или Р = const (или давление, или объем должны быть постоянными)
2. Единственной работой, совершаемой системой, является работа расширения,
3. Т = const (температура должна быть постоянной).
В термохимии различают тепловые эффекты реакций Qv и Qp
а) изохорно-изотермический режим, V, Т = const

(для макропроцесса),
(1.7)

(для элементарного процесса).
Таким образом, тепловой эффект изохорно-изотермичесого процесса равен изменению внутренней энергии термодинамической системы.
б) изобарно-изотермический режим, Р, Т = const
В этом случае система производит работу расширения:
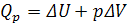
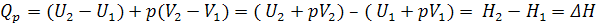
где, 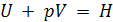 .
.
Н – энтальпия термодинамической системы.

(для макропроцесса)
(1.8)

(для элементарного процесса)
Таким образом, тепловой эффект изобарно-изотермического процесса равен изменению энтальпии термодинамической системы.
Энтальпия Н – свойство вещества, подобно U, зависит от природы и массы вещества, от условий его существования, является функцией состояния системы, так как

Для химической термодинамики наиболее интересны химические реакции, протекающие с участием газообразных веществ. В этом случае

(уравнение состояния идеального газа)
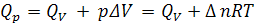
 (1.9)
(1.9)
где ∆n – изменение числа молей газообразных веществ в процессе реакции.
Если все вещества участники реакции находятся в конденсированном состоянии, то ∆H≈∆U и тепловые эффекты Qр и Qv примерно равны между собой.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 4510; Нарушение авторских прав?; Мы поможем в написании вашей работы!