
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термохимия, закон Гесса и его сущность
|
|
|
|
Лекция 2. Термохимия, закон Гесса
Вопросы для самопроверки
1. Дайте определение понятия „термодинамическая система”. Назовите типы термодинамических систем.
2. Назовите основные виды термодинамических процессов.
3. Дайте определение функции состояния. Являются ли внутренняя энергия, теплота и работа функциями состояния?
4. Какие формулировки первого закона термодинамики вам известны?
5. Напишите уравнение первого закона термодинамики и укажите, какие величины, входящие в это уравнение, зависят от пути проведения процесса.
6. Будет ли изменяться внутренняя энергия идеального газа при T = const, если этот газ подвергнуть изотермическому сжатию или расширению?
7. В изолированной термодинамической системе протекает реакция сгорания водорода с образованием жидкой воды. Изменяется ли внутренняя энергия и энтальпия данной системы?
8. Объясните, почему внутренняя энергия изолированной термодинамической системы величина постоянная?
9. Что такое тепловые эффекты Qv и QP?
10. Какова взаимосвязь между Qv и QP для химических реакций, протекающих в газовой фазе?
11. Какое практическое значение имеет первый закон термодинамики в физической химии?
2.1 Термохимия, закон Гесса и его сущность
2.2 Стандартное состояние вещества и стандартные тепловые эффекты
2.3 Следствия из закона Гесса, их роль в термохимических расчетах
2.4 Зависимость тепловых эффектов реакций от температуры. Уравнение Кирхгофа.
При химических превращениях происходит изменение внутренней энергии U системы, так как U продуктов реакции отличается от внутренней энергии прореагировавших веществ. Изучение этих изменений имеет большое значение для термодинамических расчетов, и является одним из путей определения отдельных химических связей в молекуле и количественной оценки прочности связей.
Изменение внутренней энергии U происходит в химических реакциях путем поглощения или выделения теплоты и совершения работы. Работа А обычно мала, ею можно пренебречь или вычислить. Теплота химической реакции имеет значительную величину, она может быть измерена или вычислена.
Изучением теплот химических реакций занимается термохимия – один из важнейших разделов химической термодинамики.
Тепловым эффектом химической реакции называется теплота, выделяемая (поглощаемая) в результате реакции при соблюдении определенных условий:
1. Давление или объем постоянны (р = const или V = const)
2. Не совершается никакой работы, кроме работы расширения (А' = 0)
3. Температуры исходных веществ и продуктов реакции одинаковы (Т1 = Т2)
В основе термохимии лежит закон Гесса (закон постоянства сумм теплот реакций), открытый русским ученым, академиком Гессом, на основе анализа экспериментальных данных, в 1836-1840 гг. Закон Гесса гласит:
тепловой эффект химической реакции не зависит от пути и числа промежуточных стадий, а определяется лишь природой и состоянием исходных веществ и конечных продуктов.
Закон Гесса является следствием первого закона термодинамики в применении к химическим процессам при соблюдении первых двух вышеуказанных условий. Третье условие введено для удобства сопоставления тепловых эффектов.
Закон Гесса удобно иллюстрировать термохимическими схемами с использованием замкнутых циклов.
Процесс получения СО2 (из С и О2) можно изобразить схемой

Рис. 2.1 Схема возможных путей образования СО2
С1О2  СО2
СО2
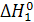
С1О2  СО1½О2
СО1½О2  CO2
CO2


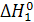 = −94,05 ккал/моль
= −94,05 ккал/моль 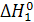 =
=  +
+ 
 = −67,64 ккал/моль
= −67,64 ккал/моль  =
= 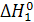 –
– = −94,05−67,64=−26,41 ккал/моль
= −94,05−67,64=−26,41 ккал/моль
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1608; Нарушение авторских прав?; Мы поможем в написании вашей работы!