
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Понятие об энтропии
|
|
|
|
В середине XIX века Клаузиус на основе второго закона термодинамики показал, что существует такая величина, которая является функцией состояния и изменение которой для обратимого изотермического процесса равно приведённой теплоте. Эта величина называется энтропией и обозначается символом S (изменение энтропии ∆S).
Изменение энтропии (∆S) в каком-нибудь процессе зависит только от начального и конечного состояния и не зависит от пути перехода.
Наиболее просто ∆S определяется для обратимых изотермических процессов. Здесь изменение энтропии равно тепловому эффекту процесса, делённому на абсолютную температуру. Например, зная, что при 0 ºС теплота плавления льда Q = 1436,3 кал/моль, легко определить, что возрастание энтропии при плавлении льда при этой температуре равно
 (3.3)
(3.3)
(в физико-химических работах S обычно выражается в Дж/моль∙К, кал/моль∙К; (последнюю размерность сокращённо часто называют энтропийной единицей, э.е.)).
Исследование цикла Карно приводит к представлению об энтропии S.
Преобразуем и проанализируем уравнение:


 (3.4)
(3.4)
(для макропроцесса)
 (3.5)
(3.5)
(для элементарного процесса)
где 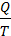 или
или – приведенная теплота.
– приведенная теплота.
Второй закон термодинамики постулирует, что существует важнейшее физическое свойство системы – энтропия, причем ее изменение в равновесном изотермическом процессе равно приведенной теплоте (второй постулат Клаузиуса, 1850).

( для макропроцесса)

(для элементарного процесса) (3.6)
Энтропия – это функция состояния, так как ее изменение удовлетворяет двум условиям:
1)  ;
;
2)  .
.
Энтропия – экстенсивное термодинамическое свойство, которое суммируется:
 (3.7)
(3.7)
Размерность энтропии совпадает с размерностью теплоемкости:
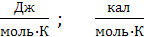
Однако физический смысл энтропии и теплоемкости различен:
1) Теплоемкость характеризует количество теплоты, необходимое для нагревания вещества на 1 (один) градус.
2)Энтропия характеризует количество рассеянной энергии, отнесенное к 1 (одному) градусу.
В общем случае при Т = const
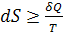 или
или 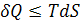 (3.8)
(3.8)
где знак = относится к равновесному процессу, > − к неравновесному процессу. Данное неравенство Клаузиуса – аналитическое выражение второго закона термодинамики через энтропию.
Расчёт изменения энтропии в различных равновесных процессах
В отличие от других параметров (Р, V, Т, ∆Н, ∆ U),характеризующих состояние системы и измеряемых экспериментально, 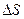 может быть вычислено только на основании равновесного процесса. Для этого необходимы опытные данные, которые используют при вычислении ∆Н (это теплоемкости веществ и теплоты фазовых превращений). В основе расчета лежит интегрирование уравнения:
может быть вычислено только на основании равновесного процесса. Для этого необходимы опытные данные, которые используют при вычислении ∆Н (это теплоемкости веществ и теплоты фазовых превращений). В основе расчета лежит интегрирование уравнения:


 (3.9)
(3.9)
Решение правой части уравнения зависит от характера термодинамического процесса.
Рассмотрим изменение энтропии в некоторых часто встречающихся случаях:
1. Энтропия фазового перехода (плавление, испарение и др.).
Поскольку Т=const, то
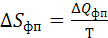 (3.10)
(3.10)
2. Энтропия сжатия-расширения n молей идеального газа (Т=const)
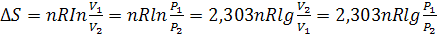 . (3.11)
. (3.11)
3. Энтропия изобарного процесса
При р=const

Если в данном температурном интервале Ср=const, то
 (3.12)
(3.12)
4. Энтропия изохорного процесса.
При V=const
 (3.13)
(3.13)
5. Если в системе, состоящей из идеального газа изменяется одновременно несколько параметров, то
 (3.14)
(3.14)
6. Энтропия смешения идеальных газов.
Пусть смешивание идет при
p= const и Т= const,
V1–объем одного газа,
V2–объем другого газа.
Энтропия каждого из газов меняется так:


Полное изменение энтропии:
 (3.15)
(3.15)
7. Изменение энтропии в результате проведения химических реакций можно рассчитать, зная абсолютные значения энтропии всех участвующих в реакции веществ.
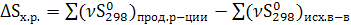 (3.16)
(3.16)
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1154; Нарушение авторских прав?; Мы поможем в написании вашей работы!