
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Таким образом, макропараметр системы – давление газа – определяется через кинетическую энергию одной молекулы и количество молекул газа
|
|
|
|
Выведем ряд следствий из основного уравнения МКТ.
1. Заменим среднюю кинетическую энергию молекулы, воспользовавшись соотношением  .
.
Уравнение (4.1) принимает вид -  . (4.2)
. (4.2)
2. Допустим, что имеем смесь газов (например, воздух). В этом случае концентрацию молекул газовой смеси следует записать, как сумму концентраций молекул газов, входящих в смесь - 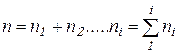 . Уравнение (4.1) принимает вид:
. Уравнение (4.1) принимает вид:
 или
или  (4.3)
(4.3)
где  - парциальное давление газа, входящего в смесь.
- парциальное давление газа, входящего в смесь.
Парциальное давление газа, входящего в смесь, - это то давление, которое оказывал бы газ, если бы он занимал объем один. Таким образом, давление смеси газов равно сумме парциальных давлений газов, входящих в смесь.
3. Заменим в уравнении (4.1) концентрацию молекул газа 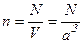 , среднюю кинетическую энергию молекулы
, среднюю кинетическую энергию молекулы 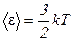 ; учтем, что
; учтем, что  и
и 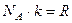 ,
,
где  - газовая постоянная.
- газовая постоянная.
Основное уравнение МКТ принимает вид:
 . (4.4)
. (4.4)
Уравнение (4.4) связывает параметры состояния газа – давление, объем, температуру – и называется уравнением состояния идеального газа.
Состояние газа характеризуется параметрами состояния. Если параметры не изменяются со временем и при этом они одинаковы по всей системе, такое состояние газа называется равновесным. Если газ переходит из одного состояния в другое, то в нем происходит процесс. Процесс будет равновесным, если промежуточные состояния равновесные. Выделяют среди процессов изопроцессы, т.е. процессы, когда один из параметров состояния остается постоянным. Воспользовавшись уравнением состояния, запишем уравнения состояния равновесных изопроцессов и изобразим их графически.
1. Изобарический процесс – это процесс, когда давление газа постоянно (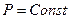 ).
).
Разделив в уравнении (4.5) постоянные и переменные величины, получим уравнение состояния газа для изобарического процесса:
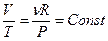 или
или  , (4.5)
, (4.5)
следовательно, объем и температура газа связаны между собой прямо пропорциональной зависимостью – увеличение объема сопровождается увеличением температуры при постоянном давлении.
Представим изобарический процесс на графиках в координатах  ,
,  ,
,  . Рис.3.
. Рис.3.

На графике в координатах  , согласно уравнению (4.5),
, согласно уравнению (4.5),  . Следовательно, при увеличении давления угол наклона прямой линии уменьшается.
. Следовательно, при увеличении давления угол наклона прямой линии уменьшается.
2. Изохорический процесс – это процесс, когда объем газа остается постоянным ( ).
).
Разделив в уравнении (4.4) постоянные и переменные величины, получим уравнение состояния газа для изохорического процесса:
 или
или  , (4.6)
, (4.6)
Давление и температура газа связаны между собой прямо пропорциональной зависимостью – увеличение давление сопровождается увеличением температуры при постоянном объеме.
Представим изохорический процесс на графиках в координатах 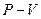 ,
,  ,
,  Рис.4.
Рис.4.
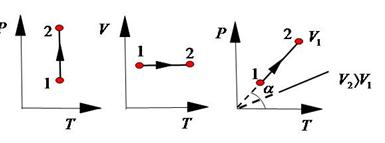
На графике в координатах  , согласно уравнению (4.6),
, согласно уравнению (4.6),  . Следовательно, при увеличении объема угол наклона прямой линии уменьшается.
. Следовательно, при увеличении объема угол наклона прямой линии уменьшается.
3. Изотермический процесс – это процесс, когда температура газа остается постоянной (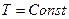 ).
).
Разделив в уравнении (4.4) постоянные и переменные величины, получим уравнение состояния газа для изотермического процесса:
 или
или 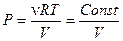 (4.7)
(4.7)
Уравнение (4.7) показывает что, давление и объем газа связаны между собой обратно пропорциональной зависимостью – увеличение давление сопровождается уменьшением объема при постоянной температуре.
Представим изотермический процесс на графиках в координатах 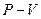 ,
,  ,
,  Рис.5.
Рис.5.

На графике в координатах 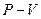 , согласно уравнению (4.7), при повышении температуры изотерма будет расположена выше.
, согласно уравнению (4.7), при повышении температуры изотерма будет расположена выше.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 316; Нарушение авторских прав?; Мы поможем в написании вашей работы!