
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия. Обратимые и необратимые процессы
|
|
|
|
Обратимые и необратимые процессы
Обратимый процесс – это процесс, который может протекать как в прямом направлении, так и в обратном направлениях, но при возвращении системы в исходное состояние в окружающей среде не происходит никаких изменений.
Любые механические процессы, протекающие без трения и без участия неупругих ударов, обратимы. Например, движение маятника, качающегося без трения. Путь, пройденный маятником за полпериода, проходится им за вторые полпериода в обратном порядке. Причем маятник возвращается в исходное состояние без того, чтобы в окружающих тела произошли какие-либо изменения. При наличии теплового движения, как правило, происходят необратимые процессы. При соприкосновении тел с различной температурой нагреватель (тело с более высокой температурой) отдает некоторое количество тепла холодильнику (тело с более низкой температурой). Этот процесс необратим – тепло всегда переходит от более горячего тела к более холодному. И никогда не наблюдается самопроизвольный переход тепла от холодного тела к горячему телу.
В цикле Карно газ, расширяясь, совершает работу, его температура понижается, т.е. он передает тепло холодильнику. Чтобы вернуть газ в исходное состояние его нужно предварительно сжать, температура его повысится и тепло возвращается нагревателю в результате работы, совершенной внешними силами. Однако, чтобы газ вернулся в исходное состояние, нагревателю надо отдать большее количество тепла, чем у него было отнято. Излишек тепла нагреватель передает окружающим телам, поэтому в окружающей среде происходят изменения. Следовательно, процесс теплообмена между телами с различной температурой необратим.
Таким образом, в природе, кроме обратимых процессов, имеют место и необратимые явления, протекающие лишь в одном направлении. Опыт показывает, что реальные тепловые процессы всегда необратимы. Очевидно, что должны существовать закономерности, указывающие направленность процессов. Эти закономерности должны быть связаны с качественными особенностями теплового движения молекул. Необходимо ввести количественную характеристику, которая бы указывала направленность процесса. Такой количественной характеристикой является величина, называемая энтропией.
Качественная особенность теплового движения молекул – его хаотичность, беспорядочность. Для характеристики теплового движения следует ввести количественную меру степени беспорядка.
Предположим, что газ состоит из четырех молекул. Поместим их в сосуд, состоящий из двух частей А и В, разделенных перегородкой. Пусть первоначально все молекулы находятся в части А, а часть В, отделенная перегородкой, пуста.
Уберем на некоторое время перегородку. Молекулы, двигаясь хаотически, будут летать по всему объему, это означает, что газ расширился. Если вновь закрыть перегородку, то в результате хаотического движения молекул может возникнуть различное количественное распределение молекул по частям сосуда. В части А может быть: 1)пусто; 2)находится одна молекула; 3) находится две молекулы (Рис.4):
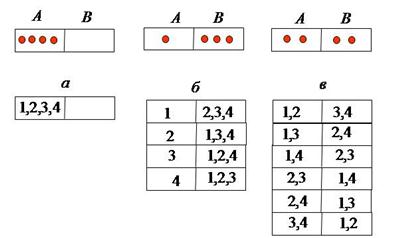
Количественное распределение молекул по частям системы называется макросостоянием. Совершенно очевидно, что различные макросостояния имеют разную вероятность своего возникновения, так как молекулы идеального газа различимы. При неизменном количественном их распределении по системе качественное распределение может быть разным. Состояние, когда все молекулы соберутся в части А может реализоваться лишь одним способом. Поэтому оно мало вероятно и практически не осуществляется вовсе. Второе состояние – в части сосуда А после закрытия перегородки оказалась одна молекула – будет реализоваться чаще. Ещё чаще будет реализовываться состояние, когда в частях А и В находится по две молекулы.
|
|
|
Дата добавления: 2014-01-07; Просмотров: 466; Нарушение авторских прав?; Мы поможем в написании вашей работы!