
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изменение энтропии численно равно количеству теплоты, сообщенной газу, в обратимом процессе деленному на абсолютную температуру тела. Эта величина называется приведенной теплотой
|
|
|
|
Качественное распределение молекул по системе называется микросостоянием. Число микросостояний, которыми может быть реализовано данное макросостояние, называется термодинамической вероятностью (W). Число непрерывно сменяющих друг друга качественных состояний, другими словами микросостояний, и характеризует степень беспорядочности макросостояния всей системы.
Чтобы рассчитать термодинамическую вероятность во всех рассматриваемых случаях пронумеруем молекулы – 1,2,3,4. Термодинамическая вероятность в первом случае равна  (Рис.4а); во втором -
(Рис.4а); во втором - 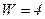 (Рис.4б); в третьем -
(Рис.4б); в третьем - 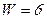 (Рис.4в).
(Рис.4в).
Однако, характеризовать степень беспорядочности молекулярного движения с помощью термодинамической вероятности неудобно, так как вероятность величина мультипликативная - термодинамическая вероятность системы равна произведению вероятностей в подсистемах:
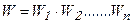
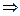
 . (6.12).
. (6.12).
Рассмотрим один из важнейших циклов – Цикл Карно. Этот цикл сыграл огромную роль в
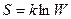 . (6.13)
. (6.13)
Тогда уравнение энтропии всей системы имеет вид:
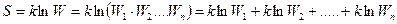 , (6.14)
, (6.14)
следовательно, 
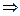
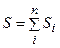 (6.15)
(6.15)
Энтропия системы – величина аддитивная - равна сумме энтропий в подсистемах. Энтропия, подобно внутренней энергии, является однозначной функцией состояния системы.
Используя, введенное Больцманом определение энтропии (6.13) как меры беспорядочности молекулярных движений, проанализируем, как ведет себя энтропия при обратимых и необратимых процессах.
Допустим, имеется один моль идеального газа, т.е. 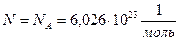 , находящийся в объеме
, находящийся в объеме 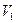 . Разделим этот объем на ячейки, в каждую можно поместить лишь одну молекулу. Определим термодинамическую вероятность размещения молекул по ячейкам в объёме
. Разделим этот объем на ячейки, в каждую можно поместить лишь одну молекулу. Определим термодинамическую вероятность размещения молекул по ячейкам в объёме 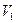 , т.е. возможное число микросостояний, с учетом свойства мультипликативности вероятности имеем:
, т.е. возможное число микросостояний, с учетом свойства мультипликативности вероятности имеем:
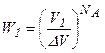
 . (6.16)
. (6.16)
Соответственно энтропия в исходном состоянии равна:
 (6.18)
(6.18)
Увеличим объем, занимаемый газом, до  . Молекулы получают возможность попадать в области пространства, ранее им недоступные. Благодаря этому возрастает число различных, возможных микросостояний и степень беспорядка возрастает, т.е. возрастает термодинамическая вероятность и энтропия:
. Молекулы получают возможность попадать в области пространства, ранее им недоступные. Благодаря этому возрастает число различных, возможных микросостояний и степень беспорядка возрастает, т.е. возрастает термодинамическая вероятность и энтропия:
 ;
;  (6.19)
(6.19)
Определим изменение энтропии в процессе расширения газа, которое представляет количественную меру увеличения степени хаотичности молекулярных движений в данном процессе:
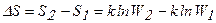 . (6.20)
. (6.20)
Подставив в уравнение (19), уравнения (17) и (18) получаем:
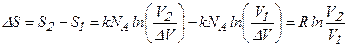 . (6.21)
. (6.21)
Пусть процесс расширения газа происходил изотермически (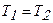 ) и обратимо. По первому началу термодинамики в случае изотермического процесса вся подводимая теплота расходуется на работу газа, которую можно рассчитать по уравнению:
) и обратимо. По первому началу термодинамики в случае изотермического процесса вся подводимая теплота расходуется на работу газа, которую можно рассчитать по уравнению:
 , если
, если 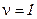 . (6.22)
. (6.22)
Сравнив уравнения (6.21) и (6.22) получаем:
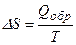 , для бесконечно малого изменения энтропии
, для бесконечно малого изменения энтропии  (6.23)
(6.23)
В тех случаях, когда теплота сообщается газу в произвольном процессе, необходимо разбить этот процесс на бесконечно малые участки. Приведенное количество теплоты, сообщенной телу на каждом бесконечно малом участке процесса равна 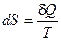 , где
, где 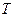 - температура соответствующего «источника теплоты». Каждый такой процесс, если он протекает бесконечно медленно, можно считать изотермическим и обратимым. Суммируя эти величины для всех участков произвольного процесса, получим выражение, которое называется интегралом приведенной теплоты:
- температура соответствующего «источника теплоты». Каждый такой процесс, если он протекает бесконечно медленно, можно считать изотермическим и обратимым. Суммируя эти величины для всех участков произвольного процесса, получим выражение, которое называется интегралом приведенной теплоты:
 . (6.24)
. (6.24)
.
При всех процессах, происходящих в макроскопических системах, энтропия системы возрастает (необратимые процессы) или остается неизменной (обратимые процессы), т.е. 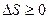 .
.
Существует несколько формулировок второго начала, предложенных великими физиками, приведем некоторые из них.
Клазиус Теплота никогда не может переходить сама собой от тел с более низкой температурой к телам с более высокой температурой.
Томсон Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара (передачи тепла от более нагретого тела к менее нагретому телу).
Планк Невозможно построить периодически действующую машину, единственным результатом которой было бы поднятие груза за счет охлаждения резервуара.
Карно Невозможно создать вечный двигатель второго рода.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 421; Нарушение авторских прав?; Мы поможем в написании вашей работы!