
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гальванический элемент
Гальванический элемент — это прибор, который преобразует химическую энергию в электрическую.
Схема простейшего гальванического элемента Даниэля представлена на рис. 35.
Схематическое изображение медно-цинкового элемента Zn°|Zn2+||Cu2+|Cu°. В такой записи одной чертой обозначается двойной электрический слой (см. рис. 36), которому соответствует электродный потенциал, а двойной чертой — электролитический ключ.
Гальванический элемент состоит из двух электродов, каждый из которых опущен в сосуд с соответствующим раствором соли: цинковый электрод погружён в раствор соли ZnSО4, а медный электрод — в раствор CuSО4. Сосуды соединены электролитическим мостиком, заполненным концентрированным раствором электролита (например, NaCl, NH4NО3 или KNО3), который служит ионным проводником между двумя сосудами.
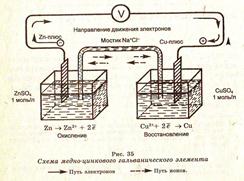
Если электроды (Zn и Сu) соединить металлической проволокой, то электроны с Zn-электрода будут переходить к Cu-электроду и в цепи появится электрический ток, который можно зарегистрировать вольтметром. Суммарное уравнение реакции, идущей в элементе: Zn° + Cu2+ = Cu° + Zn2+. Электроны от анода (Zn), который является восстановителем и заряжен отрицательно, по внешней цепи переходят к катоду (Си), который является окислителем и заряжен положительно. На электродах идут электрохимические процессы (Zn° - 2e = Zn2+ и Сu2+ + 2e = Сu0), и в растворе наблюдается направленное движение ионов.
Таким образом, в гальваническом элементе электрический ток возникает за счет окислительно-восстановительной реакции, и поэтому в принципе любая окислительно-восстановительная реакция может служить источником электрического тока, если она протекает в гальваническом элементе (см. рис. 35).
Электродвижущая сила (ЭДС) гальванического элемента (Еа) равна алгебраической сумме электродных потенциалов реакции окисления и реакции восстановления: 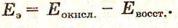
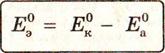
|
Е°э — стандартная ЭДС элемента,
Е°к — стандартный электродный потенциал катода,
Еа° — стандартный электродный потенциал анода.
Для медно-цинкового элемента ЭДС при стандартных условиях (Еэ) равна 1,1 В:
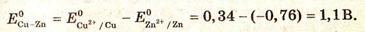
К гальваническим элементам (ГЭ) относятся элемент Даниэля-Якоби, элемент Вестона и аккумуляторы. Гальванический элемент Вестона используют как источник эталонного напряжения при измерении ЭДС гальванических элементов. Аккумуляторы предназначены для многократного использования и состоят из нескольких ГЭ, соединенных последовательно или параллельно. Наиболее распространенными аккумуляторами являются свинцовые Pb|H2S04||Pb02|Pb, железо-никелевые Fe|KOH||NiOOH|Ni и кадмий-никелевые Cd|KOH||NiOOH|Ni (вертикальные черточки обозначают границы между электродами и электролитами). В свинцовых кислотных аккумуляторах положительным полюсом является электрод из РЬ02 (в виде пасты, наполняет ячейки свинцовой решётки), отрицательным полюсом служит свинцовый электрод, а электролитом — 20-30%-й водный раствор серной кислоты.
Процесс генерирования тока (разрядка аккумулятора) в свинцовом аккумуляторе можно выразить уравнением реакции, идущей справа налево (разрядка аккумулятора):  При зарядке аккумулятора реакция идет в обратном направлении. На отрицательном полюсе: РЬ = РЬ2+ + 2е; образующиеся ионы РЬ2+ осаждаются на аноде в виде PbS04. На положительном полюсе: РЬ02 + 4Н+ + 2е=РЬ2+ + 2Н20; образующиеся ионы РЬ2+ осаждаются на катоде в виде PbS04. О степени разрядки аккумулятора судят по концентрации H2S04, замеряя ее плотность.
При зарядке аккумулятора реакция идет в обратном направлении. На отрицательном полюсе: РЬ = РЬ2+ + 2е; образующиеся ионы РЬ2+ осаждаются на аноде в виде PbS04. На положительном полюсе: РЬ02 + 4Н+ + 2е=РЬ2+ + 2Н20; образующиеся ионы РЬ2+ осаждаются на катоде в виде PbS04. О степени разрядки аккумулятора судят по концентрации H2S04, замеряя ее плотность.
В щелочном аккумуляторе отрицательным полюсом служит железная или кадмиевая пластина, положительный полюс изготовлен из никеля, заполненного Ni203, а в качестве электролита используется 20% -й раствор КОН.
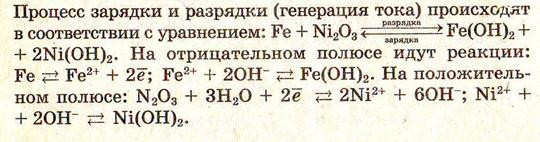
|
|
Дата добавления: 2014-01-20; Просмотров: 558; Нарушение авторских прав?; Мы поможем в написании вашей работы!