
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Абсорбция газов
|
|
|
|
Лекция №18
Абсорбцией называют процесс поглощения газов или паров из газовых или парогазовых смесей жидким поглотителем – абсорбентом. Если поглощаемый газ – абсорбтив – химически не взаимодействует с абсорбентом, то такую абсорбцию называют физической (непоглощаемую составную часть газовой смеси называют инертом, или инертным газом). Если же абсорбтив образует с абсорбентом химическое соединение, то такой процесс называют хемосорбцией. В технике часто встречается сочетание обоих видов абсорбции.
Физическая абсорбция (или просто абсорбция) обычно обратима. На этом свойстве абсорбционных процессов основано выделение поглощенного газа из раствора – десорбция. На ТЭС используют декарбонизаторы (деаэраторы) для удаления из воды растворенных газов (см. гл. 7). Десорбцию газа проводят отгонкой его в токе инертного газа или водяного пара в условиях подогрева абсорбента или снижения давления над абсорбентом. Отработанные после хемосорбции абсорбенты обычно регенерируют химическими методами или нагреванием.
Сочетание абсорбции и десорбции позволяет многократно применять поглотитель и выделять поглощенный газ в чистом виде. Чаще всего десорбцию проводить не обязательно, так как полученный в результате абсорбции раствор является конечным продуктом, пригодным для дальнейшего использования.
В промышленности абсорбцию применяют для решения следующих основных задач:
1. Для получения готового продукта (например, абсорция SО3 в производстве серной кислоты, абсорбция HCl с получением хлороводородной кислоты, абсорбция оксидов азота водой в производстве азотной кислоты и т.д.); при этом абсорбцию проводят без десорбции.
2. Для выделения ценных компонентов из газовых смесей (например, абсорбция бензола из коксового газа; абсорбция ацетилена из газов крекинга или пиролиза природного газа и т.д.); при этом абсорбцию проводят в сочетании с десорбцией.
3. Для очистки газовых выбросов от вредных примесей (например, очистка топочных газов от SO2, очистка от фтористых соединений газов, выделяющихся при производстве минеральных удобрений и т.д.). Очистку газов от вредных примесей абсорбцией используют также применительно к технологическим газам, когда присутствие примесей недопустимо для дальнейшей переработки газа (например, очистка коксового и нефтяного газов от Н2S, очистка азотоводородной смеси для синтеза аммиака от СО2 и СО и т.д.). В этих случаях извлекаемые из газовых смесей компоненты обычно используют, поэтому их выделяют десорбцией.
4. При получении СО2 и сухого льда из дымовых газов путем абсорбции и дальнейшим выделением СО2 из абсорбента десорбцией.
5. Для осушки газов, когда в абсорбционных процессах (абсорбция, десорбция) участвуют две фазы – жидкая и газовая – и происходит переход вещества из газовой фазы в жидкую (при абсорбции) или наоборот, из жидкой фазы в газовую (при десорбции), причем инертный газ и поглотитель являются только носителями компонента соответственно в газовой и жидкой фазах и в этом смысле в массопереносе не участвуют.
Аппараты, в которых проводят процессы абсорбции, называют абсорберами. Абсорберы представляют собой колонные аппараты, по конструкции почти идентичные ректификационным колоннам (см. главу 4). Только поглощаемый газ или пар (исходная смесь) чаще всего подается в нижнюю часть колонны, а жидкий поглотитель в верхнюю.
Протекание абсорбционных процессов характеризуется их статикой (равновесие) и кинетикой между жидкой и газовой фазами, определяет состояние, которое устанавливается при весьма продолжительном соприкосновении фаз. Кинетика абсорбции определяется движущей силой процесса, т.е. степенью отклонения системы от состояния равновесия, свойствами поглотителя, компонента и инертного газа, а также способом соприкосновения фаз.
Целью расчета процесса абсорбции является определение основных размеров аппарата и расхода поглотителя.
Равновесие при абсорбции [1]
При взаимодействии, какого-либо газа с жидкостью возникает система, состоящая как минимум из трех компонентов (распределяемое вещество и два распределяющих вещества или носителя) и двух фаз – жидкой и газовой. Такая система по правилу фаз имеет три степени свободы (С = К – Ф + 2 = 3 – 2 + 2 = 3).
Для данного случая массообмена переменными являются температура, давление и концентрации компонента А в газовой и жидких фазах. Следовательно, в состоянии равновесия при условии постоянства температуры и общего давления зависимость между концентрациями распределяемого в газовой и жидкой фазах компонента (или парциальным давлением газа и составом жидкости) будет однозначной. Эта зависимость выражается законом Генри: парциальное давление растворенного газа пропорционально его молярной доле в растворе:
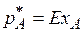 , (6.1)
, (6.1)
или растворимость газа (поглощаемого компонента А) в жидкости при данной температуре пропорциональна его парциальному давлению над жидкостью:
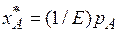 , (6.2)
, (6.2)
где Е – коэффициент пропорциональности, называемый коэффициентом, или константой Генри;  – парциальное давление поглощаемого газа, находящегося в равновесии с раствором, имеющим концентрацию
– парциальное давление поглощаемого газа, находящегося в равновесии с раствором, имеющим концентрацию 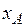 (в мол. долях);
(в мол. долях);  – концентрация газа в растворе (в мол. долях), равновесная в газовой фазе, в которой парциальное давление поглощаемого компонента равно
– концентрация газа в растворе (в мол. долях), равновесная в газовой фазе, в которой парциальное давление поглощаемого компонента равно 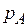 .
.
Чем выше растворимость газа в абсорбенте, тем меньше расход этого абсорбента. Поэтому при выборе абсорбента растворимость в нем поглощаемого газа рассматривается как важнейшее свойство данного абсорбента (наряду со стоимостью, доступностью, токсичностью, пожаро- и взрывоопасностью и т.п.).
Величина Е для данного газа не зависит от общего давления в системе, но зависит от природы абсорбента и поглощаемого газа и от температуры. Для некоторых газов значение Е приведено в табл. 22 приложения.
Зависимость константы Генри от температуры выражается следующим уравнением:
 (6.3)
(6.3)
где q – дифференциальная теплота растворения газа; с – постоянная, зависящая от природы газа и абсорбента.
В идеальных растворах силы взаимодействия между молекулами каждого из компонентов раствора, а также молекулами различных компонентов равны между собой. Поэтому улетучивание того или иного компонента из жидкой фазы в газовую не зависит от присутствия в растворе других компонентов и определяется содержанием в растворе данного компонента.
Для идеальных растворов на диаграмме  (рис. 6.1) зависимость равновесных концентраций от давления изображается прямой с наклоном, равным Е.
(рис. 6.1) зависимость равновесных концентраций от давления изображается прямой с наклоном, равным Е.
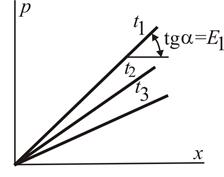 Рис. 6.1. Растворимость
газа в жидкости при различных температурах
Рис. 6.1. Растворимость
газа в жидкости при различных температурах  > >  > > 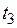 и соответственно и соответственно 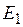 > >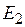 > >
| С повышением температуры значение Е увеличивается и соответственно уменьшается растворимость газа в жидкости.
При общем давлении Р в системе и концентрации 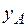 (мол. доли) извлекаемого компонента А в газовой смеси парциальное давление (мол. доли) извлекаемого компонента А в газовой смеси парциальное давление 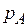 этого компонента по закону Дальтона этого компонента по закону Дальтона
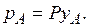
|
С учетом уравнения (6.1) получим

Тогда закон Генри можно выразить следующим образом:
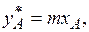 (6.4)
(6.4)
где 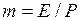 – коэффициент распределения или константа фазового равновесия;
– коэффициент распределения или константа фазового равновесия; 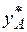 – мольная доля компонента в газовой фазе, равновесной с жидкостью.
– мольная доля компонента в газовой фазе, равновесной с жидкостью.
Если состав газа и жидкости выражен в относительных массовых концентрациях, то коэффициент распределения m умножается на поправочный коэффициент
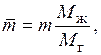 (6.5)
(6.5)
где 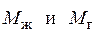 – молекулярная масса абсорбента и абсорбтива.
– молекулярная масса абсорбента и абсорбтива.
Из уравнения (6.4) следует, что зависимость между концентрациями данного компонента в газовой смеси и равновесной с ней жидкости выражается прямой линией (линия равновесия), проходящей через начало координат и имеющей угол наклона α, тангенс которого равен m. Значение величины m уменьшается при снижении температуры и увеличении давления в системе. Поэтому растворимость газа в жидкости увеличивается с повышением давления и снижением температуры.
Если в равновесии находится смесь газов, то закону Генри может следовать каждый из компонентов этой смеси в отдельности.
Как уже отмечалось, закон Генри справедлив для идеальных растворов, поэтому он применим лишь к сильноразбавленным растворам. При повышенных давлениях (порядка нескольких мегапаскалей и выше) изменение объема жидкости вследствие растворения в ней газа соизмеримо с изменением объема газа, и равновесие в этом случае не следует закону Генри. При этих условиях константа фазового равновесия равна
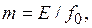
где 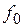 – фугитивность (летучесть) поглощаемого газа, выраженная в единицах давления.
– фугитивность (летучесть) поглощаемого газа, выраженная в единицах давления.
При выражении состава фаз в относительных концентрациях запись закона Генри видоизменяется. В этом случае уравнение (6.5) принимает следующий вид:
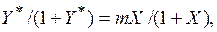
или
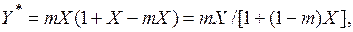 (6.6)
(6.6)
т.е. равновесие в системе газ – жидкость при выражении состава фаз в относительных концентрациях изображается кривой линией. Для сильноразбавленных растворов, т.е. при низких концентрациях газа в жидкости, можно принять 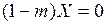 . При этом в уравнении (6.6) знаменатель обращается в единицу, и оно принимает вид
. При этом в уравнении (6.6) знаменатель обращается в единицу, и оно принимает вид
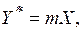 (6.7)
(6.7)
т.е. при низких концентрациях закон Генри изображается прямой линией.
Для хорошо растворимых газов, при больших концентрациях их в растворе, растворимость меньше, чем следует из закона Генри.
Для систем, не подчиняющихся этому закону, коэффициент m в уравнениях (6.5) и (6.6) является переменной величиной, линия равновесия представляет собой кривую, которую обычно строят по опытным данным.
При абсорбции многокомпонентных смесей равновесные зависимости существенно сложнее, чем при абсорбции одного компонента, особенно тогда, когда раствор сильно отличается от идеального. В этом случае парциальное давление каждого компонента в газовой смеси зависит не только от его концентрации в растворе, но также и от концентрации в растворе остальных компонентов, т.е. является функцией большого числа переменных. Поэтому обычно в таких случаях равновесные зависимости основываются на опытных данных.
Если раствор является идеальным и только в газовой фазе наблюдается отклонение от идеального состояния, то в этом случае компоненты раствора не воздействуют друг на друга. Поэтому концентрация данного компонента в газовой фазе зависит только от концентрации его в жидкости (при постоянных температуре и давлении). Тогда к каждому компоненту i можно применить уравнение (6.5):
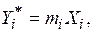
в котором константа фазового равновесия m зависит от температуры и общего давления в системе.
Следовательно, при постоянной температуре равновесие данного компонента i в разбавленном растворе на диаграмме Y – X представляется прямой линией с наклоном, тангенс которого равен 
Материальный и тепловой баланс абсорбции [ 1]
Материальный баланс непрерывного процесса абсорбции (рис. 6.2, а) представляется следующей системой уравнений:
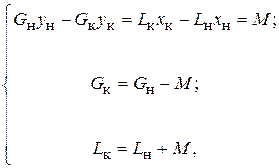
где М – количество передаваемой массы компонента А из газовой фазы в жидкую;  – расход газа начальный и конечный;
– расход газа начальный и конечный;  – расход жидкости начальный и конечный;
– расход жидкости начальный и конечный;  – начальная и конечная концентрации абсорбтива в абсорбенте (мольные доли);
– начальная и конечная концентрации абсорбтива в абсорбенте (мольные доли); 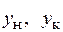 – начальная и конечная концентрация абсорбтива в газовой смеси (мольные доли).
– начальная и конечная концентрация абсорбтива в газовой смеси (мольные доли).
Составление материальных балансов упрощается, если расходы выражать через расходы инертных компонентов 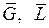 , а концентрации – через относительные концентрации
, а концентрации – через относительные концентрации
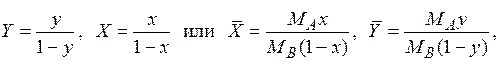 (6.8)
(6.8)
где 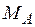 – молекулярная масса распределяемого между фазами компонента А;
– молекулярная масса распределяемого между фазами компонента А; 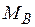 – молекулярная масса инертной части газовой смеси (компонент В); X, Y – относительные мольные концентрации;
– молекулярная масса инертной части газовой смеси (компонент В); X, Y – относительные мольные концентрации; 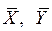 – относительные массовые концентрации.
– относительные массовые концентрации.

Рис. 6.2. Материальные потоки фаз: а – непрерывный контакт фаз;
б – ступенчатый контакт фаз
Материальный баланс абсорбции в этом случае представляется уравнениями:
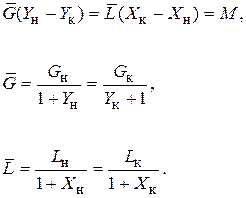 (6.9)
(6.9)
В качестве меры очистки исходной смеси от распределяемого компонента используют степень извлечения j:
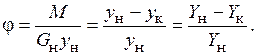 (6.10)
(6.10)
Максимально достижимая степень извлечения jmax определяется из условия равновесия уходящей из аппарата разделяемой смеси с поступающим в аппарат абсорбентом:
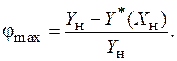
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 4201; Нарушение авторских прав?; Мы поможем в написании вашей работы!