
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сущность и особенности вольтамперометрии
|
|
|
|
Вольтамперометрия это совокупность электрохимических методов анализа, основанных на использовании вольтамперных зависимостей I = f (E), которые получают в процессе электролиза на поляризуемом электроде.
Электролитическая ячейка состоит из рабочего поляризуемого электрода с малой поверхностью и неполяризуемого электрода сравнения. В качестве материала рабочего электрода могут использоваться вещества, для которых в водном растворе характерна поляризация. Это ртуть, графит, платина, золото. В качестве электрода сравнения используются неполяризуемые электроды, например хлоридсеребряный. На электролитическую ячейку подают плавно возрастающее напряжение от внешнего источника и регистрируют протекающий в ней ток. Если в растворе отсутствуют электрохимически активные ионы, то получается зависимость I = f(E), имеющая вид представленной на рис. 24 кривой 2. Если в растворе присутствует электрохимически активное вещество, то наблюдается волна (рис. 25).
|
|

|
|
|
|
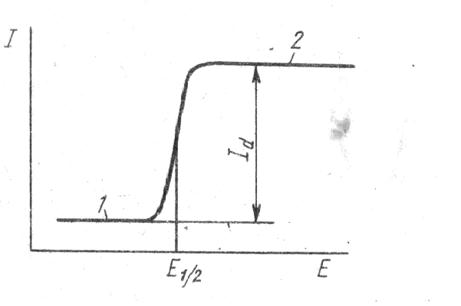
Рис. 25. Зависимость I = f (E).
На зависимости можно выделить три области.
1. Если потенциал рабочего электрода меньше потенциала выделения электрохимически активного компонента, то имеет место кинетическая поляризация электрода и на нём не протекает электрохимическая реакция. Незначительный ток, протекающий через ячейку, связан с образованием на поверхности электрода двойного электрического слоя (ДЭС), который можно уподобить конденсатору. В результате при изменении потенциала электрода протекает ток заряжения конденсатора (конденсаторный ток, ток ДЭС). Чем больше ток ДЭС, тем ниже чувствительность метода.
2. При достижении потенциала электрода, равного потенциалу выделения электрохимически активного компонента, происходит деполяризация рабочего электрода. Ионы начинают разряжаться на рабочем электроде с образованием амальгам на ртутном электроде:
Men+ + n e + Hg = M(Hg),
или металлической плёнки на твердотельных электродах:
Men+ + n e = M.
Через электрод протекает ток электролиза (фарадеев ток), который пропорционален напряжению. В результате электрохимической реакции концентрация ионов в приэлектродном слое уменьшается. Происходит перенос вещества из объёма раствора к поверхности электрода. При этом ток достаточно мал (порядка 10–5 А) и практически не влияет на концентрацию ионов в глубине раствора.
3. Концентрация ионов у поверхности рабочего электрода становится равной нулю. Перенос вещества из объёма раствора становится лимитирующей стадией и наступает концентрационная поляризация рабочего электрода. Перенос вещества из объёма раствора может происходить за счёт:
§ конвекционного переноса электрохимически активного компонента с потоком растворителя;
§ миграционного переноса ионов под действием электрического поля;
§ диффузионного переноса за счёт разности концентраций у поверхности электрода и в объёме раствора.
Конвекционный перенос происходит при перемешивании раствора, поэтому в процессе анализа раствор не перемешивают. Подавление миграционного тока достигается введением в раствор в достаточной концентрации индифферентного, т. е. не принимающего участия в реакции фонового электролита. Потенциалы восстановления и окисления этого электролита лежат вне области интересующих аналитика потенциалов. Его концентрация существенно превышает концентрацию электрохимически активного компонента. Ионы фонового электролита экранируют электрод, уменьшая тем самым силу миграции под действием электрического поля практически до нуля.
В этих условиях перенос вещества протекает исключительно за счёт диффузии. На электроде разряжаются все поступающие из глубины раствора ионы. Протекающий через электрод ток зависит только от скорости диффузии, которая зависит не от напряжения электрода, а от концентрации раствора, коэффициента диффузии, формы и размера электрода.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 560; Нарушение авторских прав?; Мы поможем в написании вашей работы!