
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Оксиды халькогенов (IV)
|
|
|
|
Лекция 5. Кислородные соединения халькогенов
1. Оксиды халькогенов (IV)
2. Оксиды халькогенов (VI)
3. Оксокислоты серы
4. Тиосерная кислота и тиосульфаты
Многообразие оксокислот серы (VI)
5. Применение
| SО2 | SеО2 | TeО2 | РоО2 | |
| Внешний вид при н.у. | Бесцветный газ с резким запахом горячей серы | Белое твердое вещество | Белое твердое вещество | Желтое кристалл. вещество |
| Темп. пл., оС | -75 | Возг. при 315 | Возг. при 450 | Разл. при 500 |
| Свойства | Кисл. оксид | Кисл. оксид Полимер | Амфот. оксид Полимер | Амфот. оксид Полимер |
| Строение |
 sp2-гибрид.
sp2-гибрид.
|
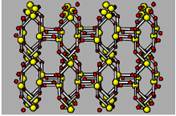 к.ч.=3
к.ч.=3
|
 к.ч.=4
к.ч.=4
| |
| Отношение к воде | Растворим
40 л/л воды
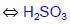
| Хорошо растворим
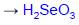
| Плохо растворим

|
В ряду SО2 - SеО2 - TeО2 - РоО2 уменьшается растворимость в воде, ослабевают кислотные свойства, усиливаются восстановительные свойства.
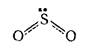
В SO2 атом серы находится в состоянии sp2-гибридизации, угол O-S-O равен 120о.
Получение:
Промышленное получение SO2 обжигом из серы, сульфидных руд, сероводорода и сульфатных руд:
S + O2 (воздух) = SO2; (280-360 °C)
4 FeS2 + 11 O2 (воздух) = 8 SO2 + 2 Fe2O3 (800°C, обжиг)
2 H2S + 3 O2 (изб.) = 2 SO2 + 2 H2O (250-300°C)
CaSO4 + C (кокс) = CaO + SO2 +CO (1300-1500°C).
В лаборатории SO2 получают действием сильных кислот на сульфиты:
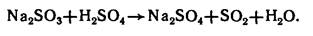
Диоксиды селена и теллура получают синтезом, они образуются при обработке простых веществ диоксидом азота, концентрированной HNO3:
Se + NO2 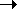 SeO2 + NO
SeO2 + NO

Однако в результате такой же обработки серы образуются производные S(VI):
S + 3 NO2 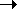 SO3 +3 NO и
SO3 +3 NO и
S + 6HNO3 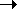 H2SO4 + 6NO2 + 2H2O.
H2SO4 + 6NO2 + 2H2O.
PoO2 можно получить слабым нагреванием (250оС) металла на воздухе.
Химические свойства диоксидов ЭО2.
Наличие неподеленной электронной пары (электронной плотности) вблизи атома серы объясняет полярность и высокую реакционную способность молекулы SО2.
1. SО2 и SeO2 - кислотные оксиды, а TeO2 и РоО2 – амфотерные оксиды.
SО2 хорошо растворяется в воде (39.3 объема в 1 объеме Н2О при 20оС, то есть около 10% по массе). Водный раствор SO2 называется сернистой кислотой. Основная часть SO2 находится в виде гидратов SО2 . nH2O. Раствор имеет кислую реакцию, но в индивидуальном виде H2SO3 не выделена из-за ее термодинамической неустойчивости.
Твердый диоксид селена также хорошо растворим в воде, и при этом образуется селенистая кислота SeO2 + H2O ↔ H2SeO3.
TeО2 и РоО2 в воде не растворяются в воде в силу высокой энергии кристаллической решетки.
2. Реагируют со щелочами (PoO2 только при сплавлении):
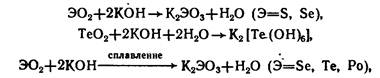
3. ЭО2 - восстановители:
 ,
,
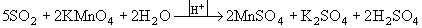 .
.
Важнейший процесс для химической промышленности и экологии - окисление SO2 кислородом до SO3: SO2+1/2O2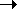 SO3, в технике осуществляется при повышенной температуре с использованием катализатора V2O5+ К2O.
SO3, в технике осуществляется при повышенной температуре с использованием катализатора V2O5+ К2O.
4. ЭО2 – окислители:
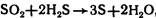
5. ЭО2 могут диспропорционировать:
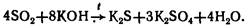
Диоксид серы фотохимически реагирует с Cl2:
SO2 + Cl2 + h
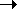 SO2Cl2.
SO2Cl2.
Первичным процессом служит фотохимическая диссоциация молекулы Cl2 на два радикала Cl..
Молекула SO2 служит нейтральным лигандом в многочисленных комплексах с переходными металлами, например: [Fe2(CO)8(SO2)]. Образование комплекса протекает по донорно-акцепторному механизму.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 2917; Нарушение авторских прав?; Мы поможем в написании вашей работы!