
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Оксокислоты серы
|
|
|
|
H2ЭО3 (С.О.=+4)
| H2SО3 | H2SeО3 | H2TeО3 | |
| Внешний вид при н.у. | устойчива только в растворе | Белое твердое вещество, гигроскопично | Белое твердое вещество, плохо растворимо в оде |
| Водные растворы | Сернистая кислота | Селенистая кислота | Теллуристая кислота |
| Кд, I Кд, II | 2∙10-2 1,2∙10-7 | 2∙10-3 5∙10-8 | 3∙10-6 2∙10-8 |
Ослабление π-связи Э=О приводит к уменьшению силы кислоты
Сернистая кислота (КI=2∙10-2, KII = 6∙10-8)
Интересной особенностью соединений S(IV) является их таутомерия, то есть существование изомеров одинакового состава, но разного строения:
HSO3- ↔ HO-SO2-
I II
В изомере I атом водорода связан с атомом серы, а в изомере II - с атомом кислорода.В концентрированных растворах гидросульфитов образуются пиросульфиты: 2HSO3 -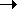 [O2S-SO3]2- + H2O, в которых реализуется связьS- S, а не - S- O- S-.
[O2S-SO3]2- + H2O, в которых реализуется связьS- S, а не - S- O- S-.
Сера (IV) в сульфит-ионе может переходить в более высокую и более низкую степени окисления, то есть выступает в качестве восстановителя и окислителя, соответственно.
Химические свойства:ω
1. Сернистая кислота действует как мягкий восстановитель в многочисленных реакциях с солями металлов:
Fe2(SO4)3 + SO2 + 2H2O = 2FeSO4 + 2H2SO4 .
В отличие от селенитов и теллуритов сернистая кислота и ее соли обладают выраженными восстановительными свойствами. Сульфиты в водных растворах медленно окисляются кислородом воздуха: 2SO32- + О2 = SO42- (аналогичная реакция, катализируемая оксидом азота NO, в атмосфере служит источником кислотных дождей).
У селенистой и теллуристой кислот восстановительные свойства выражены слабее, то есть окислить их до производных Se(VI) и Te(VI) значительно труднее.
2. Сернистая кислота – слабый окислитель. Легко протекает реакция:
H2SO3 + 2 H2S = 3 S↓ + 3 H2O.
3. Среди солей большее значение имеют сульфиты – соли сернистой кислоты. Они гидролизуются. Могут быть и окислителями, и восстановителями:
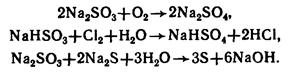
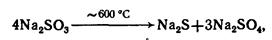
4. При нагревании твердые сульфиты щелочных металлов диспропорционируют (при нагревании в вакууме твердые сульфиты Ca, Sr, Ba разлагаются до соответствующих оксидов. MeSO3 = MeO + SO2, а на воздухе - окисляются до сульфатов):
H2ЭО4 (С.О.=+6)
| H2SО4 | H2SeО4 | H2TeО4 | |
| Внешний вид при н.у. | Бесцветная маслянистая жидкость Гигроскопична | Бесцветная жидкость Гигроскопична | Белое крист. вещество, раствор. в воде при нагревании |
| Водные растворы | Серная кислота | Селеновая кислота | Теллуровая кислота |
| Кд, I | 1,25∙103 | 2,81∙102 | 2,1∙10-8 |
| Кд, II | 0,83∙102 | 0,63 | 5,03∙10-12 |
Увеличение числа связей Э=О приводит к усилению кислот.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 1781; Нарушение авторских прав?; Мы поможем в написании вашей работы!