
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Оксиды хлора
|
|
|
|
Кислородные соединения хлора
| Свойство | Cl2O | ClO2 | Cl2O6 | Cl2O7 |
| Степень окисления | +1 | +4 | +6 | +7 |
| Температура плавления, ºС | –120,6 | –59 | 3,5 | –91,5 |
| Температура кипения, ºС | ||||
| Внешний вид | Темно-желтый газ | Желто-зеленый газ | Красная жидкость | Бесцв. жидкость |
Оксид хлора (I) Cl2O – темно-желтый газ с резким запахом. Ядовит. Молекула Cl2O имеет угловую форму (валентный угол 111º), длина связи O – Cl 170 пм. Получают оксид хлора (I) взаимодействием газообразного хлора с оксидом ртути (II) или оксидом висмута (III):

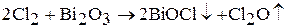
Оксид хлора (I) неустойчивое соединение, при небольшом нагревании, при соприкосновении с органическими веществами разлагается со взрывом на Cl2 и О2. Cl2O хорошо растворим в воде (при температуре 0 ºС в одном объеме воды растворяется 200 объемов Cl2O). При растворении в воде образуется хлорноватистая кислота HClO:
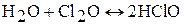
ClO2 – желто-зеленый газ с резким запахом. Ядовит. Молекула ClO2 имеет угловую форму (валентный угол OClO 117º), длина связи O – Cl 149 пм. Молекула содержит нечетное число электронов и поэтому парамагнитна.
Оксид хлора (IV) ClO2 – единственный оксид галогенов, который получают в промышленности путем пропускания оксида серы (IV) через подкисленный раствор хлората натрия NaClO3:
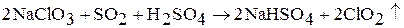
Прим. Образующийся газ в реакторе разбавляют азотом, чтобы избежать взрыва. Используется как отбеливающее средство и для обеззараживания воды.
В лабораторных условиях оксид хлора (IV) ClO2 получают взаимодействием хлората калия с щавелевой кислотой в присутствии концентрированной серной кислоты:
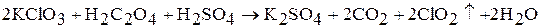
Оксид хлора (IV) – сильный окислитель. Взаимодействует с водой (медленно), со щелочью (быстро), при этом протекают реакции диспропорционирования:

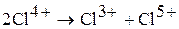
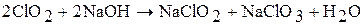
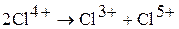
Оксид хлора (IV) ClO2 взрывоопасен, взрывается от механического воздействия, при нагревании до 100 ºС, при введении в систему восстановителя.
Оксид хлора (VI) Cl2O6 (ClO3) – вязкая красная жидкость. При обычных условиях Cl2O6 постепенно разлагается на ClO2 и О2. В газовой фазе происходит распад:
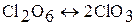
Получают окислением ClO2 озоном:
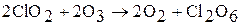
Оксид хлора (VI) – сильный окислитель. Взаимодействует с водой, со щелочью, при этом протекают реакции диспропорционирования:
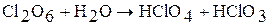


Оксид хлора (VI) взрывается при соприкосновении с органическими веществами.
Оксид хлора (VII) Cl2О7 – маслянистая бесцветная жидкость. Очень взрывоопасен. Получают путем взаимодействия оксида фосфора (V) с концентрированной хлорной кислотой:
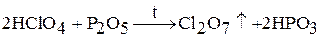
При растворении Cl2О7 в воде образуется хлорная кислота HClO4 (ангидрид хлорной кислоты):
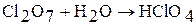
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 12800; Нарушение авторских прав?; Мы поможем в написании вашей работы!