
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ЭЛЕКТРОЛИЗ. Электролиз - разложение электротоком
|
|
|
|
Электролиз - разложение электротоком.
Электролиз - это процесс, обратный процессу, происходящему при работе гальванических элементов.
Электролизом называется превращение электрической энергии в химическую.
Через электролизёр, содержащий расплав или раствор электролита, проходит постоянный ток от внешнего источника питания. В результате на электродах начинают протекать окислительная и восстановительная реакции.
Существует три вида электролиза:
1. Электролиз расплава
Электроды в данном случае выполнены из пассивных материалов (платина, графит)
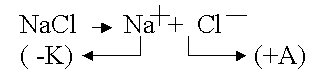 .
.
На катоде всегда происходит восстановление, на аноде - окисление
 .
.
2. Электролиз водного раствора электролита с пассивными электродами
 .
.
К катоду подходят ионы натрия и молекулы воды.
Чтобы выбрать, какое вещество будет восстанавливаться на катоде в первую очередь, надо сравнить потенциалы данных веществ
 .
.
По соотношению потенциалов этих двух веществ вода является более сильным окислителем и восстанавливается в первую очередь.
Катодное восстановление воды:
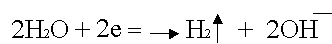 .
.
Чтобы выбрать, какое из веществ будет преимущественно окисляться на аноде, надо также сравнить их потенциалы
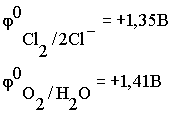 .
.
По соотношению потенциалов видно, что ионы хлора являются более сильными восстановителями и, следовательно, будут окисляться в первую очередь.
Анодное окисление хлора:
 .
.
Рассотрим ещё один пример электролиза раствора электролита с пассивными электродами:
 .
.
При таком соотношении потенциалов в первую очередь будет восстанавливаться вода:
 .
.
По соотношению потенциалов на аноде в первую очередь будет окисляться вода.
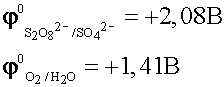 .
.
Анодное окисление воды:
 .
.
3. Электролиз раствора с активным анодом
Cu - активный анод, в качестве электролита - водный раствор H2SO4
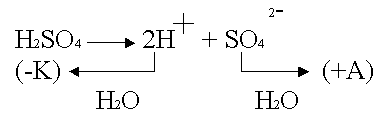 .
.
По соотношению потенциалов в первую очередь будут восстанавливаться ионы водорода из кислоты
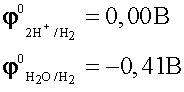 .
.
 .
.
На аноде могут окисляться три вещества:
анионы электролита, молекулы воды и сам активный анод.
 .
.
По соотношению потенциалов активный анод будет окисляться в первую очередь:
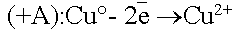 .
.
В силу диффузии ионы меди из анодого пространства, где их концентрация высока, будут перемещаться к катоду.
Когда  достигнет катода, то по соотношению потенциалов меди и водорода, начнется восстановление ионов меди:
достигнет катода, то по соотношению потенциалов меди и водорода, начнется восстановление ионов меди:
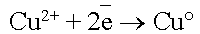 .
.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 513; Нарушение авторских прав?; Мы поможем в написании вашей работы!