
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гальванокоррозия
|
|
|
|
Коррозия металлов
Перенапряжение электрода
Перенапряжением электрода называют разность между фактическим и теоретическим электродными потенциалами.
Перенапряжение металлов настолько мало, что им пренебрегают. Велико перенапряжение водорода и кислорода.
Перенапряжение водорода велико при следующих условиях:
· малых плотностях тока,
· низких температурах раствора.
Перенапряжение также зависит от материала катода.
Перенапряжение водорода наиболее велико на тех металлах, которые в ряду напряжений располагаются вблизи водорода.
Перенапряжение водорода может играть как отрицательную, так и положительную роль.
Отрицательную роль оно играет при необходимости получить водород электролитическим путем.
Положительна роль перенапряжения при необходимости получить с помощью электролиза какой - либо металл, находящийся в ряду напряжений до водорода.
Можно создать условия (плотность тока, температура раствора, материал катода, посторонние ионы в растворе), при которых вследствие высокого перенапряжения водорода из раствора можно восстановить металлы, стоящие в ряду напряжения до водорода, (вплоть до алюминия).
Коррозия металлов - разрушение металлов под действием агрессивной окружающей среды.
Виды коррозии:
· сплошная;
· участками;
· питтинг;
· межзерновая;
· растрескивание;
· селективная.
Все виды коррозии одинаково опасны.
По механизмам протекания процесса коррозия подразделяется на химическую и электрохимическую.
Химическая коррозия:
· газовая;
· жидкостная.
Газовая коррозия происходит под влиянием агрессивных сухих газов.
Жидкостная коррозия вызывается растворами неэлектролитов. Этот вид коррозии очень характерен для продуктов нефтехимии.
Электрохимическая коррозия отличается от химической коррозии тем, что в системе возникает направленный поток электронов, т.е. электрохимическая коррозия возникает там, где присутствуют электролиты.
Электрохимическая коррозия:
· гальванокоррозия (аналогична работе гальванического элемента);
· электрокоррозия (представляет собой электролиз).
Электрохимическая коррозия гораздо активнее химической коррозии.
Гальванокоррозия вызывается многими причинами.
Основная причина возникновения гальванокоррозии - тесный контакт двух металлов с различными потенциалами, находящихся в среде электролита.
Металлы, находящиеся в тесном контакте (спай), образуют короткозамкнутый гальванический элемент.
Например, спай алюминия с медью.
По соотношению потенциалов алюминий является анодом, медь - катодом.
Рассмотрим данную гальванопару в кислой среде:
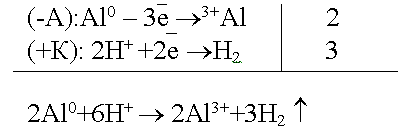
Разрушается анод, в данном случае алюминий.
Второй причиной возникновения гальванокоррозии является неоднородность металлов. Больше всего это относится к техническому железу - чугунам и сталям.
Техническое железо состоит в основном из кристаллов железа и участков цементита.

Кристаллы железа играют роль микроанодов, участки цементита - микрокатодов.
Рассмотрим данную систему в окружающей среде: воздухе с содержащейся в нём влагой (О2+2Н2О).

Следующей распространённой причиной возникновения гальванокоррозии является аэрация - неравномерный доступ кислорода (или воздуха) к разным участкам одного и того же металла.
Примером может служить вбитый во влажное дерево гвоздь. Та часть изделия (гвоздя), к которой доступ воздуха свободен, является катодом. Часть гвоздя, находящаяся в дереве, является анодом. Возникает коррозия:
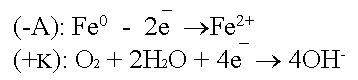
Электрокоррозия - это коррозия материалов под влиянием электрического тока от внешнего источника (коррозия блуждающих токов).
Источниками блуждающих токов являются:
· весь электротранспорт,
· электроаппараты, работающие на земле.
Поток электронов, идущий по рельсу, встречая какое -- либо омическое сопротивление, например стык, уходит в почву. Этот участок рельса становился катодом по отношению к близко расположенному участку трубопровода.
Почва по своему составу является прекрасным проводником электронов. В почве такой поток электронов может пройти десятки километров. На своём пути поток электронов встречает какой-либо металлический предмет, например, трубопровод, и входит в него.
Данный участок трубопровода становится анодом и начинает разрушаться:

Ионы Fe уходят в землю, а поток электронов направляется далее по трубопроводу до тех пор, пока не встретит какое-либо новое сопротивление.
Встретив сопротивление, электроны уходят в землю, превращая данный участок трубопровода в катод. Поток электронов может войти в тот же рельс, откуда он вышел, превращая его в анод. Катодный процесс зависит от состава почвы.
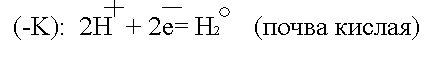
или
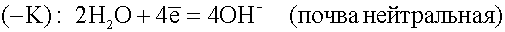 .
.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 3018; Нарушение авторских прав?; Мы поможем в написании вашей работы!