
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ефект Джоуля-Томсона для газу Ван-дер-Ваальса
|
|
|
|
Застосуємо теорію ефекту Джоуля-Томсона для реального газу, поведінка якого описується рівнянням Ван-дер-Ваальса. Диференціальний ефект описується формулою (2). Оскільки газ тече від більшого тиску до меншого, то величина 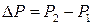 від’ємна. Якщо при протіканні крізь пробку температура газу зменшується (
від’ємна. Якщо при протіканні крізь пробку температура газу зменшується (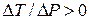 ), то ефект Джоуля-Томсона називають позитивним. В протилежному випадку, коли температура зростає (
), то ефект Джоуля-Томсона називають позитивним. В протилежному випадку, коли температура зростає (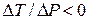 ), ефект називається від’ємним. Скориставшись рівнянням Ван-дер-Ваальса, знайдемо
), ефект називається від’ємним. Скориставшись рівнянням Ван-дер-Ваальса, знайдемо
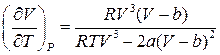
Звідки
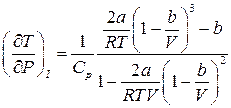 .
.
Розглянемо випадок розрідженого газу. В цьому випадку величинами 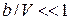 і
і 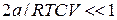 можна знехтувати і тоді
можна знехтувати і тоді
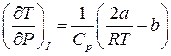 . (4)
. (4)
Оскільки 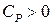 , то знак
, то знак 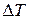 залежить від знаку виразу в дужках (4). Якщо цей вираз більше нуля, то
залежить від знаку виразу в дужках (4). Якщо цей вираз більше нуля, то 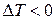 - маємо позитивний ефект Джоуля-Томсона. Коли вираз в дужках менше нуля, то
- маємо позитивний ефект Джоуля-Томсона. Коли вираз в дужках менше нуля, то 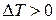 - маємо від’ємний ефект Джоуля-Томсона.
- маємо від’ємний ефект Джоуля-Томсона.
Зокрема, при b = 0, a ¹ 0 газ завжди охолоджується, оскільки при розширенні кінетична енергія теплового руху газу витрачається на роботу проти сил молекулярного притягування. При a = 0, b ¹ 0 газ завжди нагрівається. Це зрозуміти складніше, оскільки в цьому випадку міжмолекулярні сили не виконують роботи.
Результат процесу Джоуля-Томсона залежить не тільки від зміни внутрішньої енергії газу, але і від зовнішньої роботи, яку він виконує при розширенні. Процес Джоуля-Томсона є процес, що проходить при постійній ентальпії. Якщо 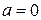 рівняння Ван-дер-Ваальса отримує форму
рівняння Ван-дер-Ваальса отримує форму  , і ентальпія
, і ентальпія
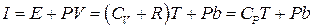 .
.
Умова постійності ентальпії дає 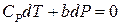 , тобто
, тобто
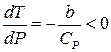 .
.
 При температурі
При температурі
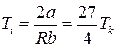
зміна температури дорівнює нулеві. Ця температура називається температурою інверсії.
Підставивши параметри конкретного газу, можна отримати температуру інверсії для кожного газу. І якщо ефект Джоуля - Томсона відбувається при температурах вище за температуру інверсії, то маємо зростання температури при протіканні газу: DT > 0. Навпаки, при температурах нижче Ті, одержуємо DT < 0.
Для більшості газів температура інверсії значно вища за кімнатну,
тому вони в процесі дроселювання крізь порувату перегородку при кімнатній температурі охолоджуються (повітря, N2, O2, CO2). Для легких газів (водню H2 і гелію Hе) з температурою інверсії нижче кімнатної, має місце нагрівання в процесі дроселювання при кімнатній температурі.
Температури інверсії деяких газів:
Ті (Не) = 50°К, Ті (Н2) = 200°К, Ті (О2) = 1063°К, Ті (СО2) = 2073°К.
Розглянемо інтегральний ефект. Інтегральний ефект, як було відзначено, отримують, коли газ проходить крізь вентиль, з різних боків якого підтримується значна різниця тисків. Зміна температури газу 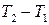 при інтегральному ефекті визначається формулою (3). В залежності від знаку підінтегрального виразу зміна температури може бути як позитивною, так і від’ємною. Зокрема, якщо у всьому діапазоні диференціальний ефект Джоуля-Томсона позитивний, то таким же буде і інтегральний ефект, тобто при дроселюванні газ повинен охолоджуватись. При кімнатних температурах це має місце для більшості газів, зокрема для повітря і вуглекислоти. Якщо примусити вуглекислоту в газоподібному стані витікати крізь вентиль під тиском 100-200 атм, то вуглекислота при значному охолодженні перейде в твердий стан. Інакше поводить себе водень. Для нього при кімнатних температурах диференціальний, а отже і інтегральний ефект Джоуля-Томсона від’ємний; при дроселюванні водень нагрівається. Таке нагрівання стиснутого водню може призвести до горіння при витіканні із пошкоджених труб.
при інтегральному ефекті визначається формулою (3). В залежності від знаку підінтегрального виразу зміна температури може бути як позитивною, так і від’ємною. Зокрема, якщо у всьому діапазоні диференціальний ефект Джоуля-Томсона позитивний, то таким же буде і інтегральний ефект, тобто при дроселюванні газ повинен охолоджуватись. При кімнатних температурах це має місце для більшості газів, зокрема для повітря і вуглекислоти. Якщо примусити вуглекислоту в газоподібному стані витікати крізь вентиль під тиском 100-200 атм, то вуглекислота при значному охолодженні перейде в твердий стан. Інакше поводить себе водень. Для нього при кімнатних температурах диференціальний, а отже і інтегральний ефект Джоуля-Томсона від’ємний; при дроселюванні водень нагрівається. Таке нагрівання стиснутого водню може призвести до горіння при витіканні із пошкоджених труб.
4. Зрідження газів. Наднизьки температури.
Зрідження газів реалізується їх стисненням при температурах нижче критичної. При цьому далеко не всі гази можуть бути переведені в рідкий стан при кімнатній температурі. Причина цього полягає в тому, що кімнатна температура є значно більшою за критичну температуру цих газів Т кр. А при Т > Т кр, газ, як ми знаємо, не переходить в рідкий стан.
У табл.1наведені критичні параметри Т кр і р кр для ряду газів.
Таблиця 1
| Речовина | Т кр, К | Р кр, ат |
| гелій (Не) | 5 (-268˚С) | 2,2 |
| водень (Н2) | 33,2 (-240˚С) | 12,9 |
| азот (N2) | 126 (-147˚С) | 33,5 |
| аргон (Ar) | 151 (-122˚С) | |
| кисень (О2) | 154,3 (-118,8˚С) | |
| вуглекислий газ (СО2) | 304,2 (31˚С) | |
| вода (Н2О) | 647,2 (374˚С) | |
| хлор (Cl2) | 417 (144˚С) | |
| аміак (NH3) | 405 (132˚С) |
З таблиці видно, для того, щоб зрідження стало можливим, потрібно спочатку охолодити, наприклад, азот до -147 ˚С, кисень до -118.8 ˚С.
Але зріджені таким чином гази зручно зберігати під атмосферним тиском, а не при високих тисках. В цьому випадку температура речовини повинна бути ще нижчою, тобто такою, при якій тиск, що відповідає горизонтальній дільниці ізотерми реального газу, дорівнював би атмосферному тиску р нас = р атм (р нас – тиск насиченої пари). Для азоту така ізотерма відповідає температурі 77.4К (-196˚С), тобто за цієї температури азот може бути переведений в рідкий стан при р атм і зберігатися в цьому стані. Для кисню ізотерма, що задовольняє вищеназваним умовам, визначається температурою 90 К (Т кр=154.4 К), для водню – 20.5 К (Т кр=33К), для гелію – 4.4 К (Т кр=5,3К). Досягнення таких низьких температур (4.4 К÷70 К) є досить складною задачею, і для їх отримання на практиці застосовують три методи, засновані на явищах: а) випаровування рідин; б) ефекту Джоуля-Томсона в реальних газах; в) оборотного адіабатного розширення газу із здійсненням зовнішньої роботи.
Отримання низьких температур за допомогою інтенсивного випаровування рідини.
За цим принципом працюють, наприклад, домашні холодильники. Робочим тілом холодильника є рідина (фреон). Компресором при його включенні ця рідина подається у випаровувач (систему трубок з великою площею перерізу). Одночасно з роботою компресору над поверхнею фреону у випаровувачі зовнішній тиск р 3 знижується так, що він стає менше тиску насиченої пари фреону р нф за даної температури р нф > р 3. Як наслідок, фреон кипить (інтенсивно випаровується) у випаровувачі. На його кипіння і витрачається теплота повітря, що знаходиться всередині холодильної камери. Молекули фреону, що “википіли” (“гарячі молекули”) всмоктуються компресором і потрапляють у конденсатор. Це такий трубчастий пристрій, де газ-фреон, віддаючи своє тепло радіатору і далі – повітрю кімнати (завдяки чому відбувається обігрів кімнати), конденсується, тобто перетворюється у рідину.
В техніці для отримання низьких температур, охолодження і зрідження газів широко застосовують методи, засновані на ефекті Джоуля-Томсона (зниження температури газу при його дроселюванні) і зниженні температури газу при його адіабатному розширенні із здійсненням зовнішньої роботи. Часто ці два методи реалізуються одночасно.
Необхідно відзначити, охолодження газу при адіабатному розширенні з виконанням роботи повинно бути більш ефективним, ніж при дроселюванні, оскільки адіабатне розширення – процес оборотній (в принципі, може бути оборотнім), в той час як ефект Джоуля-Томсона є необоротнім процесом. А, як відомо, оборотність процесів забезпечує великий коефіцієнт корисної дії машини.
Це можна показати і з допомогою розрахунку зміни температури. При адіабатному розширенні газу
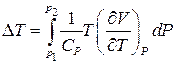 . (5)
. (5)
Порівнюючи (5) із (3), бачимо, що за рівних умов охолодження в даному випадку буде більшим. До того ж, охолодження у випадку адіабатного розширення, на відміну від дроселювання, може відбуватися також і в ідеальному газі.
Принципові схеми роботи холодильних машин, що використовують методи адіабатного розширення і дроселювання
Циклічно працююча машина для охолодження газу і його зрідження за методом дроселювання (ефекту Джоуля-Томсона) була запропонована у 1895р. інженерами Хемпсоном (Англія) і Лінде (Германія) незалежно один від одного.
Циклічно працююча машина для охолодження і зрідження газів за методом адіабатного розширення була запатентована Сіменсом ще у 1857р. Проте лише французькому інженеру Клоду в 1902р. за допомогою такого циклу вдалося отримати рідке повітря. Тому цей цикл отримання низьких температур і зрідження газів одержав назву методу Клода.
Подібно тому, як у тепловому двигуні його головна задача – здійснення роботи – досягається при розширенні газу, так і в холодильних машинах їхня мета – охолодження – досягається при розширенні газу. Тому спочатку газ повинен бути стиснутий компресором. Робота, що здійснюється компресором, і є тією роботою, за рахунок якої стає можливою у подальшому (при адіабатному розширенні) передача тепла від холодного тіла до теплого. Але при стисненні газу він нагрівається, що, звичайно, зменшує ефективність подальшого його охолодження при розширенні. Тому тепло, яке виділяється при стисненні, відводиться (наприклад, проточною водою) так, що процес стиснення може вважатися ізотермічним (T = const).
Поршень компресора 1 стискує газ у циліндрі 2. При цьому газ нагрівається. Стиснений і нагрітий газ, залишаючи циліндр, охолоджується проточною водою в резервуарі 5. Далі в установках Клода (рис.1) газ потрапляє в циліндр детандера 4 (тобто в ту частину машини, де відбувається розширення газу). В детандері газ адіабатично розширюється, виконуючи роботу по переміщені поршня 3. В установках Хемпсона-Лінде (рис.2) замість детандера знаходиться вентиль 3, через вузький отвір якого і відбувається дроселювання газу (розширення без здійснення роботи).
В обох випадках газ охолоджується. Далі газ, перш ніж знову повернутися в циліндр 2, проходить крізь допоміжний пристрій 6, що називається теплообмінником. Звичайно теплообмінник являє собою подвійну трубу. По внутрішній трубі йде газ, що потрапляє в детандер або вентиль, а по зовнішній повертається охолоджений газ. Цей охолоджений раніше газ, що тече по зовнішній трубі, знижує (додатково до зниження температури за рахунок води) температуру газу, що тече по внутрішній трубі до вентиля чи детандера. В цьому і полягає значення теплообмінника. Таким чином, після кожного ходу поршню в детандер чи до вентилю буде підходити все більш холодний газ. Нарешті, настає такий момент, коли після чергового адіабатичного розширення чи дроселювання газ починає зріджуватися.

Рисунок 1 - Схема машини Клода.
1- поршень компресора
2- циліндр компресора
3- поршень детандера
4- циліндр детандера
5- резервуар з проточною водою
6- теплообмінник
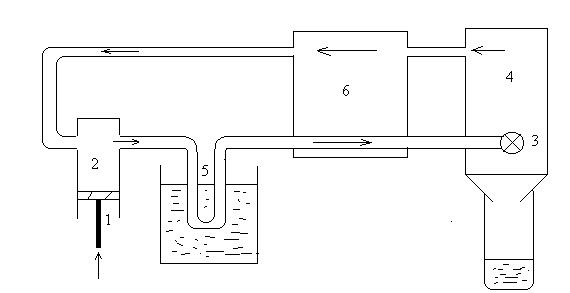
Рисунок 2 - Схема машини Хемпсона-Лінде.
(3- вентиль (замість детандера))
Описані цикли призначені для неперервного зрідження газів. Простіше здійснювати зрідження періодично методом однократного адіабатного розширення стисненого (і після стиснення охолодженого) газу.
Таким методом, який почали застосовувати лише з 1932 і 1935р., можна досягти успіху лише в тому випадку, коли теплоємкість посудини менше теплоємкості газу, що в ній знаходиться. Ця умова виконується лише при дуже низьких температурах, коли теплоємкість твердих тіл сильно спадає. Тому даний метод застосовується на практиці лише для зрідження водню і гелію.
Машини, в яких використовують адіабатичне розширення газу і ефект Джоуля-Томсона називають детандерами.
Метод охолодження, заснований на ефекті Джоуля-Томсона, є більш простим у використанні, ніж метод, в основі якого лежить адіабатне розширення газу. Зокрема, в ньому не виникає проблема змазування рухомих частин при низьких температурах, бо таких деталей при низьких температурах просто немає.
Ефективність охолодження методом Клода звичайно більша. Але даний метод технічно більш складно реалізувати. Так в методі Клода мастило, що використовують для змазування рухомих вузлів, при низьких температурах замерзає. Клод використовував для змазки прокладки з сухої шкіри.
Радянський фізик П. Капіца для вирішення проблеми змазування в машинах запропонував використати повітряний зазор замість змазки і замінити поршневий детандер турбіною. Сучасні потужні машини для зрідження газів працюють за принципом турбодетандера.
Отримання наднизьких температур
За допомогою зріджених газів можна безпосередньо охолодити інші об’єкти, оскільки теплообмін при цьому достатньо добрий. Тому задача досягнення більш низьких температур зводиться до зрідження газів і подальшого охолодження рідин.
Цей процес можна розглянути таким чином. Рідина кипить при р зовн = р н, де р н – тиск насиченої пари. Зменшуючи в посудині над поверхнею рідини зовнішній тиск р зовн, ми одночасно знижуємо і пружність насиченої пари. При цьому залишається р зовн = р н  рідина кипить.
рідина кипить.
У той же час, зниження р н (разом з р зовн) призводить до зниження температури кипіння рідини. Тому, примушуючи рідину кипіти при все нижчому значенні зовнішнього тиску, ми досягаємо все більш низьких температур у рідині.
За певної температури рідини переходять у твердий стан (за виключенням Не – II). Але теплообмін з твердими тілами відбувається неефективно. Тому за допомогою зріджених газів (охолоджених рідин) можна отримувати низькі температури в інтервалі від температури кипіння при атмосферному тиску Т к,рн до температур затвердіння Т затв. Не переходить у твердий стан лише Не4; при відкачуванні його пари досягається температура Т =0.7 К при тиску р зовн = 0.293 Па. Подальшого зниження температури гелію Не4 за рахунок відкачування пари досягти не вдалося із-за інтенсивного випаровування, коли насоси не встигають викачувати пару і знижувати тиск.
Отже, найнижча температура, яка може бути отримана за допомогою охолодження рідкого гелію Не4 дорівнює 0.7÷1 К.
Для отримання температур нижче 1 К використовують Не3, який має температуру кипіння Т к = 3.2 К при нормальному тиску р н. Відкачуючи пару над поверхнею рідкого гелію Не3, можна досягти Т = 0.3 К.
З метою досягнення температур порядку 10-3 К застосовують метод адіабатного розмагнічування парамагнітних солей. Найнижча температура, отримана в такий спосіб складає Т ≈ 0.001 К.
Зауважимо лише, що згідно третього закону термодинаміки, абсолютний нуль температури не може бути досягнутий шляхом кінцевого числа операцій.
Конкретні зріджені гази дозволили отримати такі інтервали температур:
| Речовина | Температура зрідження при р=рзовн | Температура затвердіння |
| азот | 77.32К (-196ºС) | 63.14К |
| рідкий кисень | 90.12К (-183ºС) | 54.36К |
| рідкий водень | 20.93К (-253ºС) | 14.04К |
| рідкий гелій | 4.21К (-269ºС) | 0.7К (не твердіє) |
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 2214; Нарушение авторских прав?; Мы поможем в написании вашей работы!