
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
На разрыв связей затрачивается огромная энергия, которая компенсируются выделением тепла в процессах сольватации молекул и ионов
|
|
|
|
Гидратную теорию, согласно которой молекулы вещества при растворении взаимодействуют с молекулами растворителя, образуя непрочные ассоциаты — сольваты (гидраты).
Электролитами являются вещества, имеющие сильно ионную или ковалентную сильно полярную связь.  Энергетика ЭД –
Энергетика ЭД –
u степень ЭД -отношение количества электролита, распавшегося на ионы, к общему количеству растворенного электролита:
u a0 = nр/no,
u где a0 - истинная степень ЭД,
u nр - количество молекул (формульных единиц) электролита, распавшихся на ионы в растворе;
u no - общее число молекул (формульных единиц) электролита, перешедшее в раствор.
u Степень ЭД
u прямо пропорциональна
u полярности и поляризуемости химической связи в электролите,
u диэлектрической проницаемости среды,
u температуре раствора
u и обратно пропорциональна концентрации раствора
u По степени ЭД все электролиты делятся на 2 типа: сильные электролиты (a0 > 0,7) и слабые электролиты (0<a0< 0,1).
u Сильными электролиты: сильные кислоты, щелочи и большинство солей (НС1, H2SО4, HNO3, КОН, NaOH, Ba(OH)2, NaCl, KN03).
u Слабые электролиты: слабые кислоты и слабые основания (СН3СООН, Н2СО3, HCN, HF, HNO2, NH3 •H2O) и H2O.
• Теория растворов сильных электролитов.
• Процесс ЭД сильного электролита,
• - практически необратим
• - нельзя охарактеризовать константой диссоциации.
• - велика роль межионного взаимодействия
• Активность иона a(X) - эффективная концентрация иона X, соответственно которой он участвует во взаимодействиях :
• а (Х) = f ac (Х),
• где с (Х) - концентрация иона Х в растворе,
• fa - коэффициент активности иона Х в растворе.
• Коэффициент активности иона fa показывает,
• во сколько раз активность иона отличается от его истинной концентрации в растворе сильного электролита.
• Значение коэффициента активности иона зависит от:
• 1) концентрации этого иона (сначала уменьшается, а затем растет с ростом концентрации);
• 2) температуры (увеличивается с ростом температуры);
• 3) концентрации других ионов (влияет общая концентрация всех ионов в растворе).
• Г. Льюис(1907)ввел понятие
• Ионная сила раствора I - величина, характеризующая интенсивность электростатического поля всех ионов в растворе:
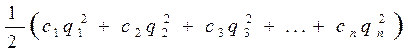 |
• I =
•
• где q1, q2, q3,...,qn - заряды всех ионов, находящихся в растворе,
• c 1, c 2, c 3,..., c n – молярные концентрации ионов.
• 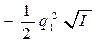 В разбавленных растворах уравнение Дебая — Хюккеля:
В разбавленных растворах уравнение Дебая — Хюккеля:
• lg fa =
u Растворы слабых электролитов.
u ЭД слабых электролитов — процесс обратимый:
u CH3COOH CH3COO- + H+.
u Используя закон действующих масс, электролитическое равновесие можно количественно выразить величиной константы ЭД:
u Кд (CH3COOH) = [H+] [CH3COO-]/ [CH3COOH],
u Кд
u - не зависит от концентрации электролита
u - определяется природой вещества, природой растворителя (с увеличением диэлектрической проницаемости - возрастает);
u - от температуры -прямопропорционально
u Степень ЭД (a) и константу ЭД связывает закон разбавления Оствальда:
u 
u = Кд.
u Слабые многоосновные кислоты и слабые многокислотные основания диссоциируют в несколько этапов (ступенчато):
u I cтупень:Н2СО3 ↔ Н+ + НСО3 -
 |
u КД1=;
u II ступень: НСО3 - ↔ H+ + CO32-
 |
u КД2 =
u Суммарно ЭД H2CO3 ↔ 2H+ + CO32-
 |
u КД(общ) =.
u КД1 >> КД2 >> КД3 и т.д.
• Коллигативные свойства разбавленных растворов электролитов
• Изотонический коэффициент показывает, во сколько раз осмотическое давление данного раствора больше теоретического:
• Р = 1000 i CRT
• Коэффициент i определяется для каждого раствора экспериментально
• -по повышению осмотического давления раствора,
• - понижению давления пара растворителя над раствором,
•  -по повышению температуры кипения и понижению температуры замерзания:
-по повышению температуры кипения и понижению температуры замерзания:
• В числителе величины экспериментальные, в знаменателе — теоретические.
•  законы Рауля:
законы Рауля:
•;
• Dtкип = iКЭ · m; Dtзам = iКК · m
• 0,1 М КCL
• 0,1 M C6H12O6
• 0,1 M (NH2)2 CO
• P КCL> PC6H12O6=P (NH2)2 CO
• Электролиты в организме человека:
• участвуют в поддержании осмотического давления,
• рН среды,
• активируют ферменты,
• создают мембранный потенциал, - участвуют в проведении нервного импульса,
• - в сокращении мышцы сердца и т.д.
• ионы организма
• можно разделить на антагонисты и синергисты.
• Те ионы, которые действуют совместно и усиливают действие друг друга, называются синергистами,(ионы калия и кальция в миокарде, ионы меди, марганца, кобальта, железа в процессе образования гемоглобина)
• Ионы, которые ослабляют действие друг друга, называются антагонистами, (ионы натрия и калия, натрия и кальция) Поэтому замена физиологического раствора [0,9% NaCl] раствором KCl той же концентрации приводит к остановке сердца.
u При приготовлении физиологических растворов необходимо учитывать их осмотические свойства, поэтому их концентрацию выражают через осмолярную концентрацию (осмолярностъ)
u Осмолярная концентрация - суммарное молярное количество всех кинетически активных, т. е. способных к самостоятельному движению, частиц, содержащихся в 1 литре раствора, независимо от их формы, размера и природы.
u Осмотическому давлению крови человека соответствует осмолярная концентрация частиц от 275 до 300 мОсм/л.
u Осмолярность считается так:
u 0,1 М NaCl 0.1х 1 + 0.1х1= 0.2 Осм/л= 200 мОсм/л.
u или:
u 0,2М СaCl2 0,2х 1+ 0.2х2= 0.6 Осм/л
Водно-электролитный баланс
В зависимости от содержания внеклеточной жидкости
различают 6 состояний, приводящих к Ý илиß
Внеклеточной жидкости:
содержание увеличено в 2 и более раза- гипергидратация
уменьшено в 2 раза- дегидратация
1. Гипертоническая дегидратация:
Р осм Ý жидкость ß
при диабете, почечной недостаточности: клетка теряет воду.
2.Изотоническая дегидратация –
Р =N жидкость ß
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 439; Нарушение авторских прав?; Мы поможем в написании вашей работы!