
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
N Комплексообразователи и лиганды нашего организма
|
|
|
|
C2H5OH
n Cu CH3—C=O + H2
n
n H
n 2. Неизменность количества катализатора и его химического состава к концу реакции.
n 3. Количество катализатора незначительно по сравнению с количеством реагирующих веществ.
n 4. Константа равновесия в обратимых реакциях не изменяется. Катализаторы не смещают химического равновесия, они в равной степени влияют и на прямую и на обратную реакцию.
n По влиянию на скорость реакции
n 1.Положительный катализ увеличивает скорость реакции [пример: горение сахара в присутствии солей лития ускоряется].
n 2. Отрицательный катализ уменьшает скорость реакции [пример: ионы Hg 2+ замедляют реакцию:
n 2KIO3 + 5Na2SO3 + H2SO4 = I2 + 5Na2SO4 + K2SO4 + H2O ].
n вещества, которые усиливают действие катализатора — промоторы, активаторы [для платины промоторами являются железо, алюминий, оксид кремния];
n Вещества, понижающие активность катализатора, - каталитические яды [мышьяк, сероводород, синильная кислота отравляют платину].
n
n По различным механизмам катализа различают:
n 1. Гомогенный.
n 2. Гетерогенный.
n 3. Микрогетерогенный.
n 4. Аутокатализ.
n 5. Катализ в скрытой форме.
n 6. Ферментативный.
l Влияние катализатора:
l Кат. образует с реагентами промежуточные, реакционноспособные соединения А…Кат, А…Кат…В, которые в дальнейшем превращаются в продукты реакции (Д) и свободный катализатор:
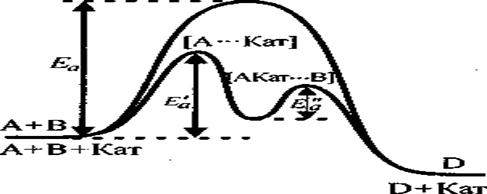
• При гомогенном катализе реагирующие вещества и катализатор составляют одну фазу — газовую или жидкую.
• нитрозный способ получения серной кислоты:
• 2SO2 + O2 = 2SO3
• C катализаторjv – NO -2 стадии, энергия активации которых ниже:
• O2 + 2NO = 2NO2
• 2SO2 + 2NO2 = 2SO3 + 2NO
• A K AK B AK AB K
• Механизм гетерогенного катализа различен. в присутствии MnO2:
• 2KClO3 = 2KCl + 3O2
• 1/ 2KClO3 + 4MnO2 = 2KCl + 2Mn2O7
• 2/ 2Mn2O7 = 4MnO2 + 3O2
• Разновидностью гетерогенного катализа является микрогетерогенный катализ, когда катализатор находится в коллоидном состоянии [ВМС] — ферменты.
• Они обладают высокой специфичностью, их активаторами являются микроэлементы
• Аутокатализ — катализ, при котором катализатором является один из продуктов реакции, например:
• 2KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + 10CO2 + K2SO4 + 8H2O
• Катализатором служат образующиеся ионы Mn2+.
• Катализ в скрытой форме.:
• ---- Вода, даже в виде следов, оказывается активным катализатором. Например, при её отсутствии хлор не реагирует с металлами, фтористоводородная кислота не разъедает стекло и т.д.
• ------Каталитическое влияние в скрытой форме оказывают стенки сосуда:
• реакция Н2 с О2 в стеклянном сосуде идёт при температуре 450˚, а в платиновом — при обычной.
• Ферментативный катализ.
• ферменты — биологические катализаторы
•. У ферментов имеется ряд уникальных свойств:
• 1. Это самые эффективные катализаторы, их активность в 106–109 раз превышает активность небиологических катализаторов.
• 2. Ферменты очень специфичны.
• 3. Способны переходить от состояния с низкой активностью к состоянию с высокой активностью.
• 4. В процессе протекания каталитической реакции может происходить постепенная инактивация фермента.
• 5. Ферменты более чувствительны к изменению внешних условий [температуры, рН среды, присутствию ингибиторов и активаторов].
• В основе ферментативной кинетики лежит уравнение Михаэлиса-Ментен:
•, где
• v — скорость реакции;
• vmax — максимальная скорость реакции;
• [S] — концентрация субстрата [свободного субстрата],
• Km — константа Михаэлиса.
• V
•  vmax
vmax
• v = vmax/2
• Km
• 

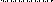
 |  | ||
• [S]
 |
• Ингибирование ферментов.
• Ингибиторами ферментов являются: антибиотики, антивирусные средства, противоопухолевые средства, инсектициды, гербициды.
• Ингибирование конкурентное: ингибитор и субстрат имеют сходные структуры и ингибитор связывает фермент. Ингибитор связывается обратимо. Пример: сульфаниламидные препараты имеют сходство с пара -аминобензойной кислотой, необходимой для синтеза нуклеиновых кислот микроорганизмов. Нужно повысить концентрацию субстрата, чтобы вытеснить ингибитор.
• Ингибирование неконкурентное: ингибитор, субстрат и фермент образуют тройной комплекс. Повышение концентрации субстрата не помогает.
• Существует и необратимое ингибирование, когда ингибиторы ковалентно связываются с ферментом [ионы ртути, свинца, мышьяка, пенициллин].
• Активаторами ферментов являются ионы калия, натрия, хлора и др
• По характеру промежуточного взаимодействия катализ различают:
• 1. Кислотно-основной.
• 2. Окислительно-восстановительный.
• 3. Металлокомплексный.
• Кислотно-основной катализ [Оствальд, Аррениус].
• При кислотно-основном катализе катализаторами являются ионы Н + [Н 3 О + ] и ОН –.
• При гетерогенном кислотно-основном катализе катализаторами могут быть нерастворимые кислоты и основания, реакции: этерификации спиртов, гидролиз сложных эфиров [ускоряется кислотами], гидролиз крахмала и др.
• Окислительно-восстановительный катализ — промежуточное взаимодействие связано с переходами электронов между катализатором и реагирующим веществом. Например:
• 2SO 2 + O 2 = 2SO 3 NO — катализатор
• О 2 + 2NO = 2NO 2 2NO 2 + 2SO 2 = 2SO 3 + 2NO
• Кинетика сложных реакций.
• Сложные реакции подразделяются на параллельные, последовательные, сопряжённые и цепные.
• А. Параллельные реакции — связанная система реакций, имеющих одни и те же исходные реагенты, но различные продукты реакции. Скорость системы параллельных реакций равна сумме скоростей отдельных реакций:
• v1 4KCl + 6O2
• 4KClO3 vобщ = v1 + v2
• v2 3KClO4 + KCl
• Б. Последовательные реакции — связанная система реакций, в которой продукты предыдущих стадий расходуются в последующих реакциях.
• Скорость реакции= скорости самой медленной (лимитирующей) стадии.
• 2NO + O2 = N2O4
• v1
• 1/ 2NO ↔ [NO]2
• v2
• 2/ [NO]2 + O2 ↔ N2O4
• В. Сопряжённые реакции — реакции, каждая из которых происходит только при условии протекания другой реакции, причем обе реакции имеют общий промежуточный продукт
• 1/ 6FeO + 2H2CrO4 = 3Fe2O3[катализатор!] + Cr2O3 + 2H2O
• 2/ 6HI + 2H2CrO4 = 3I2 + Cr2O3 + 5H2O
• Г. Цепные реакции — связанная система сложных реакций, протекающих последовательно, параллельно и сопряжённо с участием свободных радикалов [горение, взрывы, фотохимические реакции].
• Основные стадии реакции:
• а/ зарождение цепи;
• б/ разветвление цепи;
• в/ продолжение цепи;
• г/ обрыв цепи.
• Цепные реакции можно подразделить на неразветвлённые и разветвлённые. неразветвлённая реакция:
• Cl 2 + hν = Cl• + Cl•
• H 2 + Cl• = HCl + H•
• H• + Cl 2 = HCl + Cl•
• К разветвленным реакциям - полимеризации, крекинг, сгорание топлива в двигателях, окисление и др., например, ядерные цепные реакции
n фотохимические реакции — реакции, происходящие под действием лучей света [видимых, инфракрасных, ультрафиолетовых].
n Эффективность фотохимической реакции определяется так называемым квантовым выходом γ:
n γ = число молекул продукта реакции
n Фотохимические реакции бывают различных типов: а/ синтез вещества [фотосинтез] и б/ разложение веществ под действием света [фотолиз:
n hν
n 2HCl → H 2 + Cl 2
n Фотосинтез, происходящий в растениях — сложный окислительно-восстановительный процесс, сочетающий фотохимические реакции с ферментативными.
n |
n CO2 + 2H2O → [H—C—OH]n + O2
n |
Cl2 + hν = Cl• + Cl•
H2 + Cl• = HCl + H•
H• + Cl2 = HCl + Cl•
n Кислоты — жёсткие: H +, Li +, Na +, K +, Mn 2+, Cr 3+, Fe 3+, Co 3+, Mg 2+, Ca 2+;
n мягкие: Cu +, Ag +, Au +, Pt 2+, Pt 4+, Hg 2+, Cd 2+.
n Основания — жёсткие: H 2 O, OH –, NH 3, RNH 2, Cl –, PO 43–, SO 42–;
n мягкие: SCN –, R 1 S –, R 2 S, H –, S 2 O 3 2–, SH.
n правило:
n Устойчивые комплексы образуются между жёсткой кислотой и жёстким основанием или между мягкой кислотой и мягким основанием.
n:
n Ca 2+ < Mg 2+ < Mn 2+ < Fe 2+ < Cd 2+ < Co 2+ < Zn 2+ < Ni 2+ < Cu 2+
n - [Na + и К + ] присутствуют в основном в свободном виде,.
n - Са 2+, Мg 2+ существуют как в свободном виде, так и в виде комплексов.
n - Ионы тяжёлых металлов — Fe 2+,. — легче связываются с атомами азота и серы, например, в порфиринах.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 1081; Нарушение авторских прав?; Мы поможем в написании вашей работы!