
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сущность титриметрического анализа
|
|
|
|
Титриметрический анализ
Лекция
Список рекомендуемых источников:
1. Васильев В.П. Аналитическая химия: В 2 кн.: Кн. 1: Титриметрические и гравиметрические методы анализа: учеб. для студ. вузов, обучающихся по химико-технол. спец. – 4-е изд., стереотип. – М.: Дрофа, 2004. – 368 с. (С. 68 – 82).
2. Основы аналитической химии: В 2 кн.: Кн. 2: Общие вопросы. Методы разделения: учеб. для вузов / Ю.А. Золотов, Е.Н. Дорохова, В.И. Фадеева и др. Под ред. Ю.А. Золотова. – 2-е изд., перераб. и доп. – М.: Высш. шк., 2000. – 494 с. (С. 29 – 40).
Титриметрический (объемный) анализ основан на точном измерении количества реактива, израсходованного на реакцию с определяемым веществом.
В аналитической химии титр – один из способов выражения концентрации раствора, который показывает число граммов растворенного вещества в 1 мл раствора:
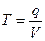 ,
,
где q – масса навески.
Зная титр, можно рассчитать нормальность раствора:
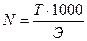 ,
,
где Э – эквивалент.
Ранее наиболее распространенным в практике способом измерения количества реактива являлось измерение объема раствора, израсходованного на реакцию. В последнее время наряду с измерением объема широко используются другие методы (взвешивание, электрохимическое превращение и др.), поэтому целесообразно использовать название титриметрического метода.
В методах классического титриметрического анализа количество реактива, израсходованного на реакцию с определяемым веществом, находят по объему раствора вещества, вступившего в реакцию. Концентрация такого раствора должна быть известна с высокой точностью. Это титрованный (стандартный, или рабочий, или титрант) раствор, а анализируемый раствор – аналит.
Аликвотная доля (аликвота) – это точно известная часть анализируемого раствора, взятая для анализа (V a, см3), которую отбирают пипеткой.
Титрование – это постепенное прибавление титрованного раствора к анализируемому для определения точно эквивалентного количества.
Момент титрования, когда количество добавленного титранта химически эквивалентно количеству титруемого вещества, называется точкой эквивалентности (т. э. или ТЭ). Ее замечают по изменению индикатора – специального вспомогательного вещества, которое вводят в титруемый раствор (внутренний индикатор). В области т. э. индикатор изменяет свой цвет, образует осадок или вызывает какой-то другой наблюдаемый эффект. Момент титрования, когда наблюдается изменение индикатора, называется точкой конца титрования (т. к. т.). В идеальном случае т. э. и т. к. т. совпадают, однако в практических условиях между ними наблюдается некоторая разница. Чем больше эта разница, тем больше погрешность титрования при прочих равных условиях, поэтому следует подбирать такой индикатор, чтобы разность между т. э. и т. к. т. была минимальной.
В противоположность внутреннему внешний индикатор в анализируемый раствор не вводится, а используется как качественный реагент на титрант или на определяемое вещество в капельном или бумажном варианте; т. к. т. в этом случае устанавливается по отрицательной реакции на определяемое вещество или по положительной реакции на титрант капельной пробы анализируемого раствора.
Реакции, лежащие в основе титриметрических методов, должны удовлетворять ряду требований. Главными из них являются следующие:
1. Взаимодействие титранта с определяемым веществом должно проходить в точном соответствии со стехиометрическим уравнением реакции, и титрант должен расходоваться только на реакцию с определяемым веществом. В то же время определяемое вещество должно реагировать только с титрантом и не взаимодействовать, например, с кислородом атмосферы, как это в принципе может быть при титровании восстановителей.
2. Реакция титрования должна протекать количественно, т. е. константа равновесия реакции титрования должна быть достаточно велика.
3. Взаимодействие определяемого вещества с титрантом должно проходить с большой скоростью.
4. Должен существовать способ, позволяющий определять окончание титрования.
5. Раствор титранта должен быть стандартизирован.
Таким образом, наиболее важными элементами методики титриметрического анализа являются выбор индикаторной системы и стандартизация раствора титранта.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 2546; Нарушение авторских прав?; Мы поможем в написании вашей работы!