
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методы титриметрического анализа
|
|
|
|
В титриметрическом анализе используют реакции различного типа: кислотно-основного взаимодействия, комплексообразования и т.д., удовлетворяющие тем требованиям, которые предъявляются к титриметрическим реакциям.
Ø По типу основной реакции:
| Метод титрования, тип реакции | Подгруппы методов | Вещества, применяемые для приготовления титрантов |
| Кислотно-основное Н3О++ ОН-=2Н2О | Ацидиметрия (Н3О+) | HCl Например: СО32- + Н+ = НСО3- |
| Алкалиметрия (ОН-) | NaOH, Na2CO3 Например: СН3СООН + ОН- = СН3СОО- + Н2О | |
| Окислительно-восстановительное а Ox1+ b Red2 = = a Red1 + bОх2 | Перманганатометрия | KMnO4 Например: MnO4- + 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4Н2О |
| Иодометрия | I2 Например: 2S2O32- + I2 = S4O62- +2I- | |
| Дихроматометрия | K2Cr2O7 | |
| Броматометрия | КВrО3 | |
| Иодатометрия | KIO3 | |
| Цериметрия | Се(SO4)2 | |
| Ванадатомегрия | NH4VO3 | |
| Титанометрия | TiCl3 | |
| Хромометрия | СгС12 | |
| Аскорбинометрия | 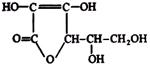
| |
| Комплексометрическое M + L = ML | Меркуриметрия | Hg(NО3)2 Пример: Hg2+ + 2С1- = HgCl2 |
| Комплексонометрия | ЭДТА Пример: Mg2+ + H2Y2- = MgY2- + 2H+ | |
| Осадительное М + Х = МХ↓(тв.) | Аргентометрия | AgNО3 Пример: Ag+ + С1- = AgCl |
| Меркурометрия | Hg2(NО3)2 Пример: Hg22+ + 2С1- = Hg2Cl2 |
Ø По способу выполнения:
1) прямое титрование: определяемое вещество непосредственно реагирует с титрантом.
Типичным примером прямого титрования является титрование щелочи кислотой.
2) обратное титрование (или титрование по остатку): используется 2 титрованных рабочих раствора – основной и вспомогательный. Сначала к анализируемому раствору добавляется заведомый избыток одного титрованного раствора, а затем не вступивший в реакцию остаток этого раствора оттитровывается другим стандартным раствором. Этот прием используется, когда прямое определение по тем или иным причинам затруднено.
Например,
· прямое титрование диоксида марганца сульфатом железа невозможно из-за малой скорости реакции:
MnО2 + 2Fe2+ + 4Н+ = Mn2+ + 2Fe3+ + 2Н2О
Поэтому навеску МnО2 обрабатывают раствором FeSO4, взятым в заведомом избытке, и нагревают до полного завершения реакции. Непрореагировавший Fe2+ отгитровывают стандартным раствором К2Сr2О7.
· Стехиометрическая реакция:
5NО2- + 2МnО4- + 6Н+ = 2Mn2+ + 5NO3- + 3Н2О
осложняется разложением азотистой кислоты, образующейся в кислой среде: 2HNO2 = NO↑ +NO2↑ +H2O
Из-за летучести оксидов азота теряется определяемое вещество. Поэтому к нитриту добавляют избыток раствора КМnО4, подкисляют и после окончания реакции оттитровывают оставшийся перманганат-ион.
3) титрование по замещению: к определяемому веществу добавляют специальный реагент, вступающий с ним в реакцию. Один из продуктов взаимодействия оттитровывается рабочим раствором.
Например,
· при иодометрическом определении меди к анализируемому раствору добавляется заведомый избыток KI и происходит реакция:
2Сu2+ + 4I- = 2CuI + I2
Выделившийся йод оттитровывают тиосульфатом.
· взаимодействие дихромат- и тиосульфат-ионов протекает нестехиометрично. Поэтому к раствору, содержащему ион Сr2О72-, добавляют раствор иодида калия, реагирующего с ним стехиометрично:
Сr2О72- +6I- +14Н+ =2Сr3+ +3I2 +7Н2О
Выделившийся в эквивалентном дихромату количестве йод оттитровывают раствором тиосульфата натрия по реакции:
I2 + 2S2О32- = 2I- + S4О62-
Известны и более сложные титриметрические методики, являющиеся комбинацией этих трех основных.
Обычно при титриметрическом определении проводят несколько параллельных титрований. При этом возможны 2 варианта: метод пипетирования и метод отдельных навесок.
1) Метод пипетирования заключается в титровании равных порций раствора (аликвот Vx), отбираемых пипеткой из мерной колбы определенного объема V0, в которой растворена навеска анализируемого вещества. Массу определяемого вещества m А вычисляют по уравнению:
m2 = c2MV0 •10-3,
подставляя в него среднее арифметическое из результатов параллельных титрований 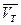 . При этом учитывают молекулярную массу эквивалента определяемого вещества М А и вводят коэффициент 10-3, поскольку все объемы выражают в миллилитрах, а концентрация титранта с т выражена в молях эквивалентов в литре:
. При этом учитывают молекулярную массу эквивалента определяемого вещества М А и вводят коэффициент 10-3, поскольку все объемы выражают в миллилитрах, а концентрация титранта с т выражена в молях эквивалентов в литре:
для прямого титрования
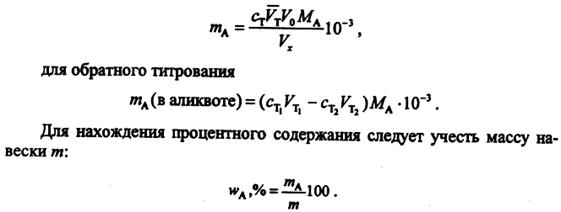
2) Метод отдельных навесок заключается в том, что n навесок вещества (m1, m2 и т.д.), взятых на аналитических весах, растворяют в небольших объемах растворителя (знать их нет необходимости) и проводят титрование в каждом растворе. В этом случае количество вещества в каждой навеске равно с т V т миллимоль и
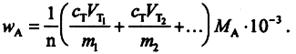
Метод пипетирования более экспрессен и менее трудоемок, но и менее точен, чем метод отдельных навесок.
Ø По способу фиксирования точки эквивалентности:
– методы титрования с цветными индикаторами,
– методы потенциометрического титрования,
– методы кондуктометрического титрования,
– методы фотометрического титрования
– и т.д.
Аналитическая характеристика каждого метода включает наиболее существенные его особенности: приготовление и свойства рабочих растворов, виды кривых титрования, погрешности определения, способы индикации ТЭ и практическое применение.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 2244; Нарушение авторских прав?; Мы поможем в написании вашей работы!