
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет результата прямого титрования при разных способах выражения концентрации раствора
|
|
|
|
Если известна молярная концентрация щелочи c (NaOH) и объем раствора V (NaOH), израсходованный на титрование кислоты, то количество вещества щелочи, затраченное на реакцию, будет равно:
 (1)
(1)
В точке эквивалентности количество вещества щелочи, израсходованное на реакцию, будет точно равно количеству вещества кислоты в анализируемом растворе:
n (NaOH) = n (HCl)
Отсюда, уравнение (1) можно переписать:
 (3)
(3)
Количество вещества эквивалента кислоты, находящееся в анализируемом растворе, можно также представить соотношением:
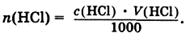 (4)
(4)
Отсюда при подстановке уравнения (4) в (3),
c (NaOH) • V (NaOH) = c (HCl) • V (HCl) (5)
Если известен объем анализируемого раствора, по уравнению (5) можно рассчитать его концентрацию. Уравнение типа (5) часто используется также при расчете различных ситуаций, возникающих при разбавлении растворов. Так как количество вещества при разбавлении раствора не изменяется, то:
с1V1 = c2V2,
где с1 и Vl – концентрация и объем раствора до разбавления; с2 и V2 – концентрация и объем раствора после разбавления.
Масса кислоты в анализируемом растворе m (НС1) рассчитывается по соотношению (6):

Вышеприведенное уравнение можно использовать для оценки погрешности прямого титриметрического анализа. В соответствии с формулой (7):
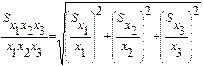 (7)
(7)
где S – дисперсия
относительная погрешность результата, вычисленного по уравнению (6), будет равна:
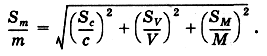
При работе с 0,1 н. растворами абсолютная погрешность установления молярной концентрации эквивалента титранта (Sc) не превышает ±0,0002, погрешность измерения объема титранта (SV) по обычной бюретке составляет не более +0,02 мл, а погрешность в величине молярной массы эквивалента (SM) пренебрежимо мала. Подставляя числовые значения в вышеприведенное уравнение, получаем:
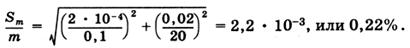
Если титруется не весь раствор щелочи, а аликвота, результат анализа рассчитывается по уравнению:

Погрешность в определении объема мерной колбы вместимостью 100 мл обычно составляет ±0,05 мл, а пипетки ±0,03 мл. Подстановка числовых значений в вышеприведенное уравнение дает:

Основной вклад в погрешность анализа вносит погрешность в определении концентрации титранта. При серийных определениях в цеховых и заводских лабораториях широко применяется способ расчета, использующий молярную концентрацию эквивалента с поправочным коэффициентом. Поправочный коэффициент равен отношению истинной концентрации (с ист) титранта к табличной его концентрации (с табл), для которой можно заранее рассчитать, какой массе определяемого вещества соответствует 1 мл титранта.
Например, 22,50 мл точно 0,1000 М NaOH нейтрализуют 0,08204 г НС1, а 22,52 мл этой щелочи – 0,08211 г НС1 и т.д.
Если истинная молярная концентрация эквивалента NaOH равна 0,1048, то поправочный коэффициент:

При расчете результатов титрования табличный результат умножают на поправочный коэффициент. Если израсходовано 22,52 мл щелочи, табличный результат равен 0,08211 г и истинная масса кислоты составит:
m (НС1) = m табл K = 0,08211 • 1,048 = 0,08605 г.
Если известен титр раствора (Т) – т. е. масса (г) растворенного вещества в 1 мл раствора, то количество вещества эквивалента щелочи, вступившее в реакцию, составит:

Способ громоздкий и менее удобный по сравнению со способом молярной концентрации эквивалента.
Широко распространен в практике способ расчета результатов анализа с помощью условного титра рабочего раствора (титра по определяемому веществу). Он показывает массу (г) определяемого вещества, которая соответствует 1 мл рабочего раствора. В данном примере 1 мл 0,1048М NaOH соответствует 0,003821 г НС1, т. е. T (NaOH/HCl) = 0,003821.
Тогда результат анализа:
т (НС1) = Т (NaOH/HCl) • V (NaOH) = 0,003821 • 22,52 = 0,08605 г НС1 (8)
Чтобы найти связь между разными способами выражения концентраций, приравняем массу определяемого вещества, рассчитанную при использовании разных способов.
Пусть, например, известна молярная концентрация эквивалента NaOH, требуется рассчитать Т (NaOH/HCl). Приравниваем правые части уравнений: (6) и (8):

|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 3801; Нарушение авторских прав?; Мы поможем в написании вашей работы!