
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Экспериментальное определение электропроводности
|
|
|
|
Значение электропроводности нельзя определять аналогично тому, как она определяется в проводниках первого рода (металлах). Связано это с тем, что необходимо создавать условия, при которых gradmi = 0. Это обусловлено наличием градиента химического потенциала, который обязательно вызовет дополнительную диффузию ионов, не связанную с электропроводностью. Поэтому для экспериментального измерения электропроводности используется переменный ток при частоте от 1 кГц и выше. Диффузией при измерениях электропроводимости можно пренебречь, если использовать мостовую схему, приведённую на рисунке 6.1.
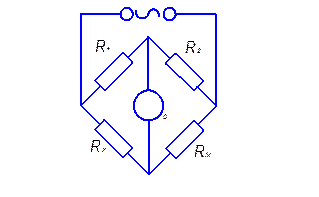
Рис. 6.1 Схема моста переменного тока.
В состоянии баланса (при отсутствии напряжения на нуль – индикаторе) выполняется соотношение 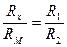 .
.
Состояние баланса достигается варьированием сопротивлением R M при постоянных значениях R1 и R2 (Rx –это сопротивление исследуемого электролита). Как и для обычных металлических проводников, сопротивление растворов можно рассчитать по формуле:
 , (6.9)
, (6.9)
r - удельное сопротивление материала; l – длина проводника; S – площадь поперечного сечения. В случае измерения электропроводности растворов S – площадь электродов, а l расстояние между ними (рис. 6.2).

Рис. 6.2 Схема ячейки для измерения электропроводности
Таким образом, определив значение Rx по данной схеме и используя уравнение (6.9), можно рассчитать величину удельного сопротивления электролита. Обычно в справочниках приводится обратная величина k - удельная электропроводимость электролита.
.
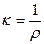 (6.10)
(6.10)
Из (6.9) и (6.10) получаем:
 (6.11)
(6.11)
Размерность удельной электропроводности Ом-1×см-1 или См×м-1 (См – сименс).
Удельная электропроводность – это электропроводимость раствора, заключённого между двумя параллельными электродами, имеющими площадь 1м2 и расположенными на расстоянии 1м друг от друга.
Если с использованием схемы, приведённой на рис. 6.1, определить удельные электропроводности различных растворов в зависимости от их концентрации, то можно наблюдать следующую зависимость (рис. 6.3).
При максимальном разбавлении растворавеличина его удельной электропроводности стремится к удельной электропроводности чистой воды (~ 10-5 См/м).
Как видно из рисунка 6.3 зависимость электропроводности от концентрации, как правило, имеет максимум. Вследствие ион – ионного взаимодействия ее величина снижается при высоких концентрациях. Наличие такой аномальной зависимости делает неудобным использование величин удельной электропроводности, поэтому целесообразно ввести понятие эквивалентной электропроводности, которое обозначается буквой l и определяется соотношением:
 (6.12)
(6.12)

Рис. 6.3 Зависимость удельной электропроводности от концентрации растворов.
Согласно (6.12) эквивалентная электропроводность является удельной электропроводностью отнесенной к единице концентрации раствора. Она представляет собой электропроводность объёма электролита, содержащего 1г - эквивалент растворённого вещества, находящегося между двумя параллельными электродами, расположенными на расстоянии 1м друг от друга (размерность м 2/Ом×г - экв.).
Если бы потоки миграции не зависели от ион – ионного взаимодействия, то l сохраняло бы постоянство при всех концентрациях. Однако при высоких концентрациях эквивалентная электропроводность не постоянна (рис. 6.4). При бесконечном разбавлении раствора, она стремится к своему постоянному значению.
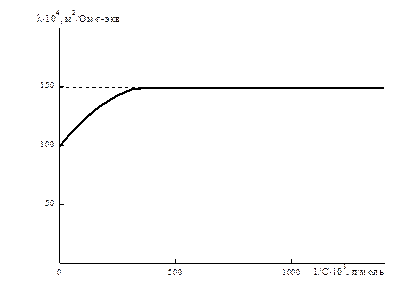
Рис. 6.4 Зависимость эквивалентной электропроводности от разбавления.
Существует связь между эквивалентной электропроводностью l и абсолютной скоростью движения ионов Ui.
 , (6.13)
, (6.13)
где a - степень диссоциации и 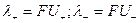 , а U+, U- - абсолютные подвижности катиона и аниона.
, а U+, U- - абсолютные подвижности катиона и аниона.
Величины l+ и l- носят названия подвижностей ионов. Для сильных электролитов (a = 1):
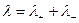 (6.14)
(6.14)
При бесконечном разбавлении:
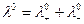 , (6.15)
, (6.15)
где 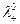 и
и 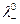 - предельные подвижности ионов.
- предельные подвижности ионов.
Таблица 6.1
Предельные подвижности ионов в воде при различных температурах.
| Ион | 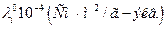
| ||||
| 0°С | 18°С | 25°С | 45°С | 100°С | |
| Li+ Na+ K+ [(CH 3)4 N ]+ [(C 2 H 5)4 N ]+ | 19,4 26,5 40,7 24,4 16,4 | 32,8 42,8 63,9 28,2 | 38,7 50,1 73,5 44,9 32,7 | 73,7 103,5 - - | - - |
| F– Cl– Br– I- CH3COO - | - 42,6 41,4 20,1 | 47,3 66,5 | 65,4 76,4 76,8 40,9 | - 108,9 110,7 108,6 - | - - - - |
Из приведенных в таблице 6.1 значений подвижностей ионов следует, что наблюдается:
1. увеличение подвижности ионов с увеличением температуры (в отличие от металлов);
2. увеличение подвижности ионов с ростом кристаллографических радиусов ионов, однако, разветвленное строение иона приводит к ее снижению.
Противоречие между увеличением подвижности иона и величиной его кристаллографического радиуса чисто кажущееся. Если рассматривать поведение гидратированного иона по аналогии с шаром в жидкости, то согласно закону Стокса скорость его движения обратно пропорциональна радиусу
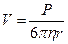 , (6.16)
, (6.16)
где P – давление; h - динамическая вязкость и r – радиус шара.
Кроме того, чем меньше радиус иона, тем большее поле он создаёт, а, следовательно, больше гидратирован. Таким образом, совместное влияние уравнения (6.16) и гидратации иона имеет в качестве своего следствия наличие максимальной электропроводности у ионов большего кристаллографического радиуса. Для многих растворов характерно эмпирическое правило Вальдена – Писаржевского.
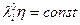 (6.17)
(6.17)
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 2254; Нарушение авторских прав?; Мы поможем в написании вашей работы!