
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Буферные растворы
Рассмотрим смесь слабой кислоты и ее соли, образованной сильным основанием. Например, смесь водных растворов уксусной кислотыи ацетата натрия. Запишем реакцию диссоциации кислоты:
CH3COOH  CH3COO- + H+. (5.и)
CH3COO- + H+. (5.и)
Тогда 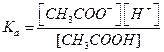 , (5.14)
, (5.14)
откуда  . (5.15)
. (5.15)
Обозначим: (a <<1, слабая кислота) и концентрацию ацетат – ионов через C2, тогда
(a <<1, слабая кислота) и концентрацию ацетат – ионов через C2, тогда 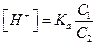 . Подставляя полученное уравнение в (5.3), получаем:
. Подставляя полученное уравнение в (5.3), получаем:
 (5.16)
(5.16)
Аналогично для слабого основания и его соли, образованной сильной кислотой, получим:
 (5.17)
(5.17)
Рассмотрим свойства уравнений (5.16) и (5.17)
1. pH раствора не зависит от разбавления (уменьшения концентрации). При разбавлении в одинаковой степени будет меняться концентрация соли и кислоты, а, следовательно, pH раствора остается постоянным;
2. если взять высокую концентрацию соли и кислоты, то небольшое изменение кислотности не будет сказываться на величине pH. Аналогично для уравнения (5.17) при высокой концентрации основания и его соли изменение основности раствора не будет сказываться на значении pH.
Растворы, pH которых мало зависит от вносимых изменений концентраций ионов водорода (гидроксила) называются буферными растворами. Они представляют собой смеси слабой кислоты и ее соли, образованной сильным основанием или смесь слабого основания и его соли, образованной сильной кислотой.
Существуют буферные растворы, позволяющие поддерживать постоянство практически любых значений pH (как кислых, так и щелочных).
|
|
Дата добавления: 2014-01-13; Просмотров: 569; Нарушение авторских прав?; Мы поможем в написании вашей работы!