
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вопросы и задачи
|
|
|
|
Пример 1.
Образование йодистого водорода протекает по реакции
H 2 + J 2 = 2 HJ
Исходная концентрация водорода равна 1 моль/л, а йода – 0,6 моль/л. Рассчитать концентрации всех трех веществ в момент равновесия, если при некоторой температуре в реакцию вступило 50% водорода. Чему равна константа равновесия?
РЕШЕНИЕ. Из уравнения реакции видно, что вследствие взаимодействия одного моля Н2 с одним молем J2 образуется 2 моля HJ. По условию задачи, в реакцию вступило 50% исходной концентрации Н2, т.е. 0,5 моль/л Н2 и столько же молей J2, при этом образовался 1 моль НJ.
Следовательно, в момент равновесия, концентрации веществ были равны:
[ H2 ]=1 моль/л – 0,5 моль/л = 0,5 моль/л
[ J2 ]= 0,6 моль/л – 0,5 моль/л = 0,1 моль/л
[ HJ ]= 1 моль/л
Константу равновесия рассчитывает по уравнению, являющемуся следствием закона действующих масс:
К = 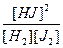 = 1/0,5·0,1 = 20
= 1/0,5·0,1 = 20
Пример 2.
Кажущаяся степень диссоциации раствора, содержащего 2,925 г NaCl в 50 г воды, равна 0,80. Найти температуру замерзания раствора.
РЕШЕНИЕ. Находим изотонический коэффициент i соли, приходящееся на 1000 г воды, из пропорции: 2,925:50 = х:1000; х = 58,5. Это – вес одной грамм-молекулы NaCl. По определению, Δ T = КС (1), где Δ T – понижение температуры замерзания раствора, С – концентрация (моляльная) растворенного вещества в молях на 1000 г растворителя. Из уравнения (1) видно, что когда С = 1, Δ T = К, т.е. К есть коэффициент пропорциональности для данного растворителя. Для воды он равен 1,86оС. Коэффициент К в уравнении (1) называют криоскопической постоянной.
Фактически Δ T зависит от коэффициента i, который можно найти из уравнения (4.4) 0,80 = i - 1/ 2-1; i = 1,8, отсюда Δ T = iКС и Δ T = 1,86·1,8 = 3,37о. Значит температура замерзания раствора NaCl = -3,37оС.
1. В обратимой реакции А + B = С + D исходные концентрации А и B равны 1 моль/л, а константа равновесия К = 5. Вычислить равновесные концентрации А и B.
2. Вычислить константу химического равновесия для обратимой реакции А + B = 2С, если равновесная концентрация равна [ А ] = [ B ] = 0,1 моль/л, [ С ] = 0,4 моль/л.
3. Равновесие реакции 2 NO + О 2 = 2 NO 2 установилось при следующих концентрациях веществ: [ NO ] = 1,12 моль/л, [ О 2] = 0,56 моль/л, [ NO 2] = 0,88 моль/л. Рассчитать константу равновесия и исходные концентрации окиси азота и кислорода.
4. Раствор 1,7 г ZnCl 2 в 250 г воды замерзает при температуре – 0,24оС. Вычислить степень диссоциации соли.
5. Определить уксусная кислота сильный или слабый электролит, если раствор, содержащий 0,57 г кислоты в 100 г воды, замерзает при температуре – 0,181оС.
6. Температура замерзания раствора 2,93 г NaCl в 50 г воды – 3,35оС. Определить степень диссоциации.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 1201; Нарушение авторских прав?; Мы поможем в написании вашей работы!