
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидролиз солей. Гидролиз солей - это взаимодействие солей с водой
|
|
|
|
Гидролиз солей - это взаимодействие солей с водой. В зависимости природы соли, т.е. какой кислотой и основанием (по силе) она образована, при растворении соль будет давать разную pH среды (кислотную, щелочную или нейтральную).
Рассмотрим вначале процесс гидролиза хлорида аммония. При этом учтём, что все соли диссоциируют полностью, а вода является слабым электролитом.
NH4Cl 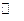
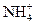 + Cl–
+ Cl–
H2O 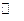 OH- + H+
OH- + H+
¯
NH4Cl + H2O 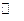 NH4OH+
NH4OH+ 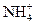 + Cl– + H+
+ Cl– + H+
¯ ¯(pH < 7)
(малодиссоциирующее соединение) (избыток ионов водорода)
Таким образом, соль сильной кислоты и слабого основания при гидролизе всегда будет создавать кислую среду.
Рассмотрим другой пример – соль, образованная сильным основанием и слабой кислотой:
CH3COONa 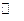 CH3COO-+ Na+
CH3COO-+ Na+
H2O 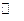 H+ + OH–
H+ + OH–
¯
CH3 COO Na + H2O 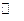 CH3 COOH + Na+ + OH–
CH3 COOH + Na+ + OH–
¯ ¯(pH > 7)
(малодиссоциирующее соединение) (избыток ионов гидроксила)
То есть соль слабой кислоты и сильного основания всегда будет давать при растворении щелочную реакцию.
Соль же сильной кислоты и сильного основания, слабой кислоты и слабого основания при своём растворении будет давать среду, зависящую от соотношения силы кислоты и силы основания.
pH при гидролизе можно рассчитать для:
соли сильной кислоты и слабого основания
pH = 7 – 0,5 pKb – 0,5 lgCab;(5.11)
соли слабой кислоты и сильного основания
pH = 7 + 0,5 pKа + 0,5 lgCab; (5.12)
соли слабой кислоты и слабого основания
pH = 7 + 0,5 pKа - 0,5 pKb, (5.13)
где Cab концентрация растворенной соли.
Согласно (5.13) pH при гидролизе соли слабой кислоты и слабого основания зависит только от константы диссоциации (ионизации) кислоты и основания, и не зависит от концентрации соли.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 564; Нарушение авторских прав?; Мы поможем в написании вашей работы!