
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Особые случаи электропроводности электролитов
|
|
|
|
Ионы водорода (гидроксония) и гидроксила обладают аномально высокой подвижностью. Из сравнения данных таблиц 6.1 и 6.2 видно, что их подвижность приблизительно на порядок выше, чем у остальных ионов.
Таблица 6.2
Подвижности ионов водорода и гидроксила.
| Ион | 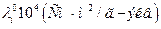
| ||||
| 0°С | 18°С | 25°С | 45°С | 100°С | |
| H + OH - | - |
Причина заключается в структуре молекул воды, их упорядоченном расположении и наличии большого числа водородных связей.

Рис. 6.5 Структура молекулы воды.
Ион водорода H+ окружён гидратной оболочкой из молекул воды. Чаще всего этот ассоциат имеет состав H9O4 +. Механизмэлектропроводности можно проиллюстрировать следующим уравнением:

(6.б)
Вначале молекула разворачивается, а затем происходит туннельный переход, то есть по существу осуществляется только перенос заряда по эстафетному механизму. Этим и обусловлена высокая подвижность иона водорода.
Очень часто зависимость эквивалентной электропроводности от концентрации отличается от приведенной на рис. 6.1 и имеет гораздо более сложный характер (рис. 6.6).
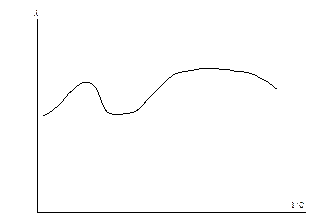
Рис. 6.6 Аномальная зависимость эквивалентной электропроводности от разбавления.
В этом случае при определённых концентрациях возможно образование ассоциатов, которые распадаются при разбавлении. Поэтому электропроводность необходимо всегда определять экспериментально.
Причиной образования ассоциатов и их распада являются взаимодействия растворителя и растворенного вещества, а также образование и разрыв водородных связй.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 494; Нарушение авторских прав?; Мы поможем в написании вашей работы!