
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Скорость химической реакции
|
|
|
|
| Химическая кинетика – наука о скоростях химических реакций. |
| Скорость гомогенной химической реакции определяется количеством вещества, вступившего в реакцию или образовавшегося в результате реакции за единицу времени в единице объема |

А + B = C + D








С2 < C1 ΔC < 0 C2 > C1 ΔC > 0
ΔC = С2 – С1
Δt = t2 – t1
[ ] =
] = 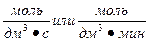
| Изменение концентрации исходных веществ в процессе реакции | Изменение концентрации продуктов в процессе реакции |
Скорость гетерогенной химической реакции определяется количеством вещества, вступившего в реакцию или образовавшегося в результате реакции за единицу времени на единице поверхности раздела фаз:   [ [ ] = ] = 
|

| Закон действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам при формулах этих веществ в уравнении реакции | |||
| nA + mB = qD | |||
V = k• V = k•
V = k•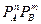 (для газообразных участников)
(для газообразных участников)
| V – скорость химической реакции CA и CB – концентрации веществ PA и PB – парциальные давления газов k – константа скорости реакции | ||
| Правило Вант-Гоффа: при повышении температуры на каждые 10оС скорость большинства реакций возрастает в 2 – 4 раза | |||


|  и и 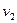 – скорости реакции соответственно при
Т1 – начальная температура
Т2 – конечная температура
γ – температурный коэффициент скорости реакции (значения лежат обычно в интервале 2 – 4)
t1 и t2 – время протекания реакции при соответствующих температурах – скорости реакции соответственно при
Т1 – начальная температура
Т2 – конечная температура
γ – температурный коэффициент скорости реакции (значения лежат обычно в интервале 2 – 4)
t1 и t2 – время протекания реакции при соответствующих температурах
| ||
|
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 360; Нарушение авторских прав?; Мы поможем в написании вашей работы!