
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическое равновесие
|
|
|
|
| Обратимые реакции – реакции, протекающие одновременно в двух противоположных направлениях | Необратимые реакции – реакции, протекающие до конца и не изменяющие своего направления при изменении температуры и давления. | ||
| Ca(OH)2 DCaO + H2O N2 + 3H2 D 2NH3 | BaCO3 → BaO + CO2↑ Pb(NO3)2 + 2NaCl → PbCl2 ↓+ NaNO3 | ||
Химическое равновесие – состояние системы, при котором скорости прямой и обратной реакции равны: vпр = vобр.
для обратимой реакции а А + b B D c C + d D
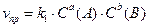 ; ; 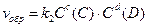 ; т.к. скорости равны, то ; т.к. скорости равны, то
 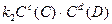 => => 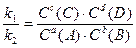 ;
поскольку константы скоростей k1и k2 величины постоянные, то их отношение в состоянии равновесия также величина постоянная и называется константой равновесия (K): ;
поскольку константы скоростей k1и k2 величины постоянные, то их отношение в состоянии равновесия также величина постоянная и называется константой равновесия (K):
 K = K = 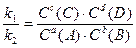
| |||
| При химическом равновесии: - ни прямая, ни обратная реакции не прекращаются, хотя в системе не наблюдается никаких внешних изменений - количество исходных веществ, прореагировавших в единицу времени, равно количеству этих же веществ, образовавшихся за то же время из продуктов реакции. - изменение условий реакции (концентрации веществ, температуры или давления) приводит к смещению химического равновесия, т.е. к нарушению равенства скоростей прямой и обратной реакции При этом: - если концентрации исходных веществ уменьшаются, а концентрации продуктов увеличиваются, то говорят, что равновесие смещается вправо (в сторону прямой реакции) - если концентрации исходных веществ увеличиваются, а концентрации продуктов уменьшаются, то говорят, что равновесие смещается влево (в сторону обратной реакции) | |||
| Принцип Ле Шателье Если на систему, находящуюся в состоянии равновесия оказать какое-либо воздействие извне (изменить температуру, концентрацию, давление), то равновесие сместится в направлении той реакции, протекание которой ослабляет эффект произведенного воздействия. | |||
|
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 620; Нарушение авторских прав?; Мы поможем в написании вашей работы!