
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительные реакции (ОВР)
|
|
|
|
В соответствии с принципом Ле Шателье.
Закономерности в смещении химического равновесия
| Фактор | Направление смещения равновесия |
| Повышение концентрации исходного вещества | В сторону прямой реакции (вправо) |
| Понижение концентрации продукта реакции (вывод продукта из сферы реакции) | В сторону прямой реакции (вправо) |
| Понижение концентрации исходного вещества | В сторону обратной реакции (влево) |
| Повышение концентрации продукта | В сторону обратной реакции (влево) |
| Повышение давления ≡ уменьшение объема системы | В сторону меньшего числа молей |
| Понижение давления ≡ увеличение объема системы | В сторону большего числа молей |
| Повышение температуры | В сторону эндотермической реакции |
| Понижение температуры | В сторону экзотермической реакции |
| ОВР – реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ | |
| Восстановление – процесс принятия электронов | Окисление – процесс отдачи электронов |
| Окислитель принимает электроны, при этом восстанавливается. Степень окисления элемента понижается. | Восстановитель отдает электроны, при этом окисляется. Степень окисления элемента повышается. |
Э + n  → Э –n → Э –n
| Э – n  → Э +n → Э +n
|

| Важнейшие окислители | Вещества, проявляющие окислительно-восстанови-тельную двойственность | Важнейшие восстановители |
| Азотная кислота (разбавленная и концентрированная) HNO3, серная концентрированная кислота H2SO4, перманганат калия KMnO4, манганат калия K2MnO4, оксид марганца (IV) MnO2, хромат калия K2CrO4, бихромат калия K2Cr2O7, оксид свинца(IV) PbO2, фтор F2, хлор Cl2, кислород O2, озон O3, катионы некоторых металлов: Ag+, Au3+. | Азотистая кислота HNO2, сера S, оксид серы (IV) SO2, сернистая кислота H2SO3, катионы железа Fe2+ | Металлы, водород H2, углерод C, оксид углерода (II) CO, сероводород H2S, галогеноводородные кислоты HCL, HBr, HI (кроме фтороводородной), аммиак NH3, гидразин N2H4, некоторые катионы металлов:, Mn2+, Cr3+ |
Классификация окислительно-восстановительных реакций
| Межмолекулярные: атомы окислителя и восстановителя являются атомами различных химических элементов и входят в состав разных веществ | Mn+4O2 + 4HCl– → Mn+2Cl2 + Cl02 + 2H2O Mn+4 + 2ē → Mn+2 2 1 окислитель 2Cl– – 2ē → Cl02 2 1 восстановитель |
| Внутримолекулярные: атомы окислителя и восстановителя являются атомами различных химических элементов и входят в состав одного вещества | 2KN+5O-23 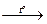 2KN+3O2 + O02
N+5 + 2 ē → N+3 2 2 окислитель
2O-2 – 4ē → O02 4 1 восстановитель 2KN+3O2 + O02
N+5 + 2 ē → N+3 2 2 окислитель
2O-2 – 4ē → O02 4 1 восстановитель
|
| Диспропорционирование: атомы окислителя и восстановителя являются атомами одного химического элемента, входят в состав одного вещества и имеют одинаковую степень окисления | 3Cl02 + 6KOH 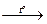 KCl + 5KCl+5O3 + 3H2O
Cl02 + 2ē → 2Cl– 2 5 окислитель
Cl02 – 10ē → 2Cl+5 10 1 восстановитель KCl + 5KCl+5O3 + 3H2O
Cl02 + 2ē → 2Cl– 2 5 окислитель
Cl02 – 10ē → 2Cl+5 10 1 восстановитель
|
| Компропорционирование: атомы окислителя и восстановителя являются атомами одного химического элемента с различной степенью окисления и могут входить как в состав одного вещества, так и в состав различных веществ. | 2H2S -2 + S+4O2 → 3S0 + 2H2O
S+4 + 4ē → S0 4 1 окислитель
S-2 – 2ē → S0 2 2 восстановитель
N-3H4N+5O3 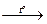 N+2O + 2H2O
N+5 + 4ē → N+ 4 1 окислитель
N-3 – 4ē → N+ 4 1 восстановитель N+2O + 2H2O
N+5 + 4ē → N+ 4 1 окислитель
N-3 – 4ē → N+ 4 1 восстановитель
|
|
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 419; Нарушение авторских прав?; Мы поможем в написании вашей работы!