
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фармакологические подходы к коррекции нарушений пуринового обмена
|
|
|
|
Мочевая кислота – конечный продукт пуринового обмена у человека. Увеличение ее уровня в организме может быть обусловлено 2 процессами:
º Увеличением образования мочевой кислоты в организме.
º Снижением выведения мочевой кислоты из организма.
Образование мочевой кислоты в организме. Основная часть пуринов в организме образуется за счет синтеза de novo в печени (см. схему 1). Источником синтеза являются рибозо-5-фосфат, АТФ и аминокислоты. Вначале образуется фосфорибозил-пирофосфат (ФРПФ), затем из него через ряд стадий клетка получает ИМФ, который трансформируется в АТФ и ГТФ. Ключевым ферментом синтеза на этой стадии является фосфорибозил-пирофосфат синтаза (ФРПФ-С).
По мере выполнения своей функции АТФ и ГТФ подвергаются разрушению, при этом из АТФ в итоге образуется гипоксантин, а из ГТФ – гуанин. Именно гипоксантин и гуанин выступают в роли метаболических предшественников мочевой кислоты. Эти азотистые основания окисляются до ксантина, который в дальнейшем подвергается окислительной трансформации в мочевую кислоту. Ключевым ферментом окисления служит ксантин-оксидаза. Однако, в мочевую кислоту окисляются не все азотистые основания. Часть клеток, не имея возможности синтезировать достаточное количество пуринов de novo, приспособилась регенерировать пурины из продуктов их распада. Особый фермент гипоксантин-гуанин фосфорибозил трансфераза (HG-PRT) способен восстанавливать гипоксантин и гуанин до ИМФ и обеспечивать тем самым ресинтез АТФ и ГТФ.
Полагают, что повышение образования мочевой кислоты при подагре, таким образом может быть следствием 2 генетических дефектов:
· Резкого повышения активности фосфорибозил-пирофосфат синтазы – при этом во много раз увеличивается синтез пуринов, а значит и их распад.
· Утраты активности HG-PRT – при этом нарушается ресинтез пуринов из гипоксантина и гуанина и они способны только окисляться с образованием мочевой кислоты.
Выведение мочевой кислоты из организма. 95% мочевой кислоты выделяется в мочу путем фильтрации в клубочках почек, однако, практически вся мочевая кислота в последующем подвергается реабсорбции в проксимальных отделах канальца. Затем, она вновь секретируется в дистальных канальцах в мочу и далее 80% кислоты окончательно реабсорбируется в кровь, а 20% - выводится с мочой. Всего за сутки экскретируется 300-600 мг (1,8-3,6 ммоль) мочевой кислоты.
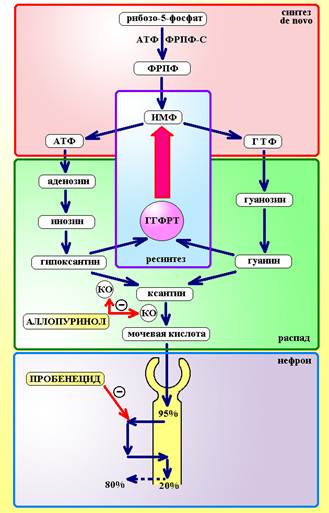 Схема 1. Образование мочевой кислоты в организме. ФРПФ-С – фосфорибозил пирофосфат синтаза, ГГФРТ – гипоксантин-гуанин фосфорибозил трансфераза, КО – ксантиноксидаза. Образование мочевой кислоты является результатом 2 процессов – распада пуринов до гипоксантина и гуанина и ресинтеза из них вновь ИМФ. Окисление гипоксантина и гуанина до мочевой кислоты осуществляет ксантиноксидаза. Аллопуринол блокирует активность этого фермента, а пробенецид нарушает реабсорбцию мочевой кислоты и увеличивает ее выведение.
Схема 1. Образование мочевой кислоты в организме. ФРПФ-С – фосфорибозил пирофосфат синтаза, ГГФРТ – гипоксантин-гуанин фосфорибозил трансфераза, КО – ксантиноксидаза. Образование мочевой кислоты является результатом 2 процессов – распада пуринов до гипоксантина и гуанина и ресинтеза из них вновь ИМФ. Окисление гипоксантина и гуанина до мочевой кислоты осуществляет ксантиноксидаза. Аллопуринол блокирует активность этого фермента, а пробенецид нарушает реабсорбцию мочевой кислоты и увеличивает ее выведение.
|
Полагают, что повышение уровня мочевой кислоты при подагре может быть связано со снижением ее выведения, например, при чрезвычайно высокой реабсорбции кислоты из мочи в кровь.
Накопление мочевой кислоты в организме не может быть беспредельным. При физиологическом рН максимальная концентрация растворимой формы мочевой кислоты составляет 7,0 мг/100 мл. Если ее уровень превышает эту границу, мочевая кислота начинает кристаллизоваться и выпадать на поверхности синовиальных (внутренних) оболочек суставов. Клетки синовиальной оболочки поглощают кристаллы уратов и выделяют хемотаксичесике вещества:
· Простагландины – они привлекают в очаг воспаления лейкоциты и вызывают их размножение.
· IL-1 – он привлекает в очаг воспаления макрофаги.
Макрофаги и нейтрофилы фагоцитируют кристаллы уратов и это вызывает выделение из них повреждающих факторов:
· LTB4 – вызывает отек и боль.
· Гликопротеинов – вызывают продукцию молочной кислоты, которая снижает рН менее 7,0 и растворимость мочевой кислоты понижается еще более, образование кристаллов уратов интенсифицируется.
· Лизосомальных ферментов – вызывают повреждение суставного хряща.
Клинически это состояние проявляется внезапным приступом болей в суставах (обычно это сустав большого пальца ноги, голеностопный сустав). Боли невыносимы, сустав опухает и малейшее прикосновение к нему приносит неизъяснимые страдания. Приступы подагры вначале редки, но постепенно все учащаются, а «светлые» (безболевые) промежутки между ними становятся все короче.
По мере прогрессирования заболевания мочевая кислота откладывается вдоль канальцев и клубочков нефронов почек, вызывая их разрушение подобно суставам. Развивается хроническая почечная недостаточность, от которой и погибает пациент.
Таким образом, современные подходы к лечению подагры включают 2 принципиальных направления: урикостатическую и урикозурическую терапию.
Урикозурическими называют лекарственные средства, которые усиливают выведение мочевой кислоты из организма и применяются в межприступный период.
Урикостатическими называют лекарственные средства, которые тормозят синтез мочевой кислоты в организме. Их также применяют в межприступный период.
Классификация средств, применяемых для лечения подагры
I. Средства, для купирования приступов подагры: колхицин, пироксикам, индометацин, фенилбутазон, диклофенак.
II. Средства, для профилактики приступов подагры:
A. Урикостатические средства: аллопуринол.
B. Урикозурические средства: пробенецид, сульфинпиразон, бензбромарон.
C. Комбинированные средства: уродан, алломарон.
 Колхицин (Colchicine) Алкалоид, содержащийся в безвременнике великолепном (Colchicum speciosum Stev.) и крокусе осеннем (Colchicum automnale).
Колхицин (Colchicine) Алкалоид, содержащийся в безвременнике великолепном (Colchicum speciosum Stev.) и крокусе осеннем (Colchicum automnale).
МД: Колхицин связывается с особыми рецепторами на поверхности димеров молекул тубулина макрофагов и нейтрофилов и нарушает их полимеризацию в микротрубочки.
Микротрубочки – особые клеточные органеллы. Они представляют собой цилиндр из полимеризованных ab-димеров тубулина. При этом на каждой микротрубочке непрерывно протекает 2 процесса – с одного конца идет полимеризация и пристройка все новых и новых молекул тубулина, с другого конца трубочка также непрерывно деполимеризуется. Если преобладает полимеризация – трубочка растет и выполняет в клетке следующие специфические функции:
· Микротрубочки формируют веретено деления и обеспечивает транспорт генетического материала при делении клетки.
· Микротрубочки обеспечивают транспорт везикул в цитоплазме клетки к ее мембране, для последующего выделения.
Поскольку колхицин блокирует полимеризацию тубулина, в микротрубочках макрофагов и лейкоцитов начинает преобладать процесс деполимеризации и они разрушаются. Это приводит к нескольким следствиям:
· Нарушается деление макрофагов и нейтрофилов в очаге воспаления, а значит уменьшается размер поражения.
· Разрушение микротрубочек вызывает прекращение экзоцитоза везикул и выделения их содержимого из клетки. Не выделяется LTB4 из макрофагов и нейтрофилов, а значит, уменьшаются боль и отек. Не выделяется гликопротеин, а значит, уменьшается образование молочной кислоты и рН смещается в более щелочную сторону. Это повышает растворимость уратов и замедляет образование новых кристаллов. Наконец, не выделяются лизосомальные ферменты, которые повреждают сустав.
ФК: Колхицин после перорального применения хорошо всасывается и его концентрация в плазме крови достигает пика в течение 2 часов. Однако, следует помнить, что уровень колхицина в плазме не позволяет контролировать его эффективность – действие колхицина определяется исключительно его концентрацией в лейкоцитах. Метаболизм колхицина протекает в печени.
ФЭ: Колхицин облегчает боль и воспаление при приступе подагрического артрита. Действие колхицина уникально по своей точности и избирательности – он устраняет боль и воспаление, которые вызваны исключительно подагрой и не способен купировать суставные боли другого происхождения. Иногда эту избирательность действия колхицина используют с диагностическими целями для терапии ex juvantibus.
Эффект колхицина развивается у 75% лиц в течение 12-24 часов и выражен тем сильнее, чем раньше после начала приступа был введен колхицин.
Для колхицина характерны и некоторые другие эффекты:
· Он снижает температуру тела.
· Колхицин нарушает синтез амилоида и коллагена в соединительной ткани.
Показания к применению и режимы дозирования:
1. Купирование острого приступа подагры. Колхицин назначают внутрь. Первая доза 0,5 мг, затем по 0,25-0,5 мг каждые 2 часа, но не более 6 мг/сут. Следует помнить, что летальная доза колхицина составляет 8 мг/сут. Как правило, у 95% пациентов, достаточной оказывается доза 0,5-1,0 мг/сут.
2. Длительное лечение подагры (профилактика приступа подагры). Используют минимально возможные дозы, т.е. такие дозы, которые еще позволяют предотвратить возникновение приступов. Эти дозы могут составлять от 0,5 мг 2 раза в неделю, до 0,5-1,0 мг/сут. Больным подагрой следует помнить, что при любом плановом хирургическом вмешательстве для профилактики приступа подагры им следует принимать колхицин по 0,5 мг 3 раза в день за 3 суток до операции и в течение 3 суток после нее.
3. Колхицин применяется также для лечения периодической болезни (семейной средиземноморской лихорадки). Периодическая болезнь – наследственное заболевание, связанное с рецессивным геном в 16 хромосоме. Оно возникает преимущественно у представителей «древних наций» - армян, арабов, евреев и проявляется приступами болей в грудной клетке и животе, повышением температуры и артралгиями. Таких пациентов часто ошибочно оперируют по несколько раз по поводу аппендицита, холецистита, панкреатита и т.п. Однако, приступы заболевания спонтанно разрешаются. По мере течения периодической болезни в почках начинает откладываться особый белок – амилоид, который приводит к развитию тяжелой ХПН.
Причина заболевания до конца не установлена. Полагают, что у пациента имеется аномально высокая активность фермента дофамин-b-гидроксилазы, которая приводит к избыточному образованию у них норадреналина и октопамина, способствующих синтезу амилоида.
Прием колхицина в дозе 0,5 мг/сут позволяет резко снизить активность дофамин-b-гидроксилазы и остановить синтез амилоида.
4. В дозе 0,5 мг/сут колхицин применяют для лечения билиарного цирроза печени. Он позволяет замедлить развитие соединительной ткани в печени и прогрессирование цирроза.
НЭ: Колхицин останавливает деление всех быстро пролиферирующих клеток: кроветворных, эпителия ЖКТ, волосяных луковиц. Это может привести к развитию анемии, тяжелой диареи и язвенно-некротическому поражению ЖКТ. Диарея, вызванная повреждением эпителия, усиливается за счет влияния колхицина на моторные центры ЖКТ и стимуляции его перистальтики.
Колхицин проникает через ГЭБ и оказывает влияние на ЦНС:
· Угнетает дыхательный центр;
· Повышает активность вазоконстрикторного отдела сосудодвигательного центра и уровень АД;
· Усиливает действие веществ, угнетающих ЦНС.
Отравление колхицином развивается при его приеме в дозе более 8 мг/сут. Проявляется геморрагическим энтеритом (боли в животе, кровавая рвота и диарея), жжением кожи, тяжелой дегидратацией и развитием острой почечно-печеночной недостаточности. Весьма характерным признаком является появление восходящего паралича мышц. В тяжелых случаях смерть наступает от угнетения дыхания или острой сердечной недостаточности. Лечение отравления симптоматическое, антидотов нет, гемодиализ неэффективен.
ФВ: драже по 0,5 мг.
Для купирования приступов подагры также используют некоторые НПВС: индометацин, диклофенак, пироксикам, фенилбутазон или прибегают к парентеральному введению глюкокортикостероидов. Данные методы лечения приступа более безопасны, по сравнению с колхицином, хотя их эффективность и несколько ниже.
 Аллопуринол (Allopurinol, Purinol) Является изомером гипоксантина. МД: Аллопуринол является конкурентным ингибитором ксантиноксидазы. Он связывается с активным центром фермента и не позволяет ему окислить гипоксантин и ксантин до мочевой кислоты. Сам аллопуринол окисляется чрезвычайно медленно, в процессе его окисления образуется аллоксантин (оксипуринол). Аллоксантин также, подобно аллопуринолу, инигибирует ксантиноксидазу, при этом он выступает в роли неконкурентного ингибитора – соединяется с аллостерическим центром фермента и снижает его сродство к гипоксантину и ксантину.
Аллопуринол (Allopurinol, Purinol) Является изомером гипоксантина. МД: Аллопуринол является конкурентным ингибитором ксантиноксидазы. Он связывается с активным центром фермента и не позволяет ему окислить гипоксантин и ксантин до мочевой кислоты. Сам аллопуринол окисляется чрезвычайно медленно, в процессе его окисления образуется аллоксантин (оксипуринол). Аллоксантин также, подобно аллопуринолу, инигибирует ксантиноксидазу, при этом он выступает в роли неконкурентного ингибитора – соединяется с аллостерическим центром фермента и снижает его сродство к гипоксантину и ксантину.
Т.о. аллопуринол выступает не просто в роли ингибитора фермента, а в роли субстрата «летального синтеза»: ксантиноксидаза сама синтезирует из аллопуринола вещество, которое угнетает ее активность.

Схема 2. Урикостатическое действие аллопуринола. Ксантиноксидаза окисляет гипоксантин и ксантин до мочевой кислоты. Аллопуринол окисляется этим ферментом до аллоксантина. И аллопуринол, и аллоксантин являются мощными ингибиторами ксантиноксидазы (показано синими стрелками) и блокируют фермент.
После применения аллопуринола синтез мочевой кислоты прекращается и метаболизм пуринов заканчивается на стадии гипоксантина и ксантина. При физиологических значениях рН растворимость ксантина в 3 раза, а растворимость гипоксантина – в 30 раз выше, чем у мочевой кислоты. Т.о. у пациента прекращается образование кристаллов уратов в суставах и прогрессирование болезни останавливается.
ФК: Аллопуринол хорошо всасывается после приема внутрь (абсорбция»80-90%). Период полуэлиминации аллопуринола составляет 1-2 часа, при этом он трансформируется в аллоксантин, период полуэлиминации которого 18-30 часов. По своему урикостатическому эффекту аллоксантин несколько уступает аллопуринолу.
Аллопуринол равномерно распределяется по тканям организма за исключением ЦНС (в головном мозге его уровень составляет ⅓ от уровня других тканей). Интересно отметить, что уровень аллопуринола и аллоксантина в плазме абсолютно не коррелирует с его терапевтическим эффектом.
ФЭ:
1. Урикостатический эффект. Аллопуринол останавливает синтез мочевой кислоты в течение 24 часов после однократного приема. После прекращения курсового лечения эффект сохраняется 3-4 дня. Аллопуринол особенно показан тем пациентам, у которых экскреция уратов с мочой превышает 600 мг/сут (это указывает на избыточное их образование).
2. Антиоксидантный эффект. Аллопуринол блокирует ксантиноксидазу в ишемизированных тканях и не позволяет в них генерироваться активным формам кислорода (супероксидному и гидроксидному радикалам). Т.о. аллопуринол защищает ишемизированные ткани от повреждения.
Показания для применения. Аллопуринол применяют для планового лечения подагры (профилактика приступов), а также для профилактики развития подагры при цитостатической и лучевой терапии опухолевых заболеваний (т.к. при этом у пациента происходит интенсивный распад нуклеиновых кислот и пуринов с образованием большого количества мочевой кислоты).
Иногда аллопуринол назначают пациентам с мочекаменной болезнью при уратных камнях. Применение аллопуринола позволяет замедлить рост уратных камней, т.к. снижается синтез мочевой кислоты.
Режим дозирования. Прием аллопуринола начинают со 100 мг/сут и при хорошей переносимости каждую неделю дозу увеличивают на 100 мг. Оптимальные дозы составляют:
· При легком течении подагры – 100-300 мг/сут;
· При среднетяжелом течении – 300-600 мг/сут;
· При тяжелой подагре – 700-900 мг/сут.
На фоне лечения аллопуринолом рекомендуется обеспечить суточный диурез на уровне 2 литров, при этом рН мочи желательно удерживать нейтральной или слабощелочной, т.к. это будет способствовать переходу уратов в растворимую форму.
Для профилактики гиперурикемии при лечении опухолевых заболеваний аллопуринол назначают в дозе 600-800 мг за 2-3 дня до начала лечения и продолжают прием в течение всего курса терапии.
НЭ: В целом аллопуринол хорошо переносится и достаточно редко вызывает нежелательные эффекты (»3% пациентов).
1. Аллергические реакции (экзантема, лихорадка) – наиболее часто развиваются в первые 2 месяца лечения.
2. Диспепсические явления – тошнота, рвота, боли в животе, диарея, повышение уровня ферментов печени.
3. Транзиторная тромбоцитопения, лейкопения или лейкоцитоз, апластическая анемия.
4. Провокация острого приступа подагры в начале лечения. Прием аллопуринола приводит к падению уровня уратов в крови, при этом начинается мобилизация мочевой кислоты из подагрических узелков в суставах и других депо. Это вызывает приступ подагры. В связи с такой особенностью лечение аллопуринолом рекомендуют начинать только после ликвидации острого приступа подагры и в первые 2-3 месяца лечения применять НПВС для профилактики острого приступа подагры.
5. Поскольку аллопуринол блокирует ксантиноксидазу, он будет замедлять метаболизм противоопухолевых средств из группы аналогов пуринов (меркаптопурин, тиогуанин и др.) и увеличивать их терапевтическое и токсическое действие. Поэтому если пациент принимает аллопуринол, то доза таких лекарств должна быть снижена на 25-30%.
6. Аллопуринол усиливает нежелательные эффекты непрямых антикоагулянтов, фенитоина, теофиллина, т.к. замедляет их метаболизм. Усиливает депонирование железа в печени.
ФВ: таблетки по 100 и 300 мг.
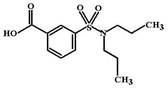 Пробенецид (Probenecid) Является слабой органической кислотой. МД: Как уже было упомянуто выше, выведение мочевой кислоты в почках после ее фильтрации связано с 2 процессами – реабсорбцией и последующей секрецией.
Пробенецид (Probenecid) Является слабой органической кислотой. МД: Как уже было упомянуто выше, выведение мочевой кислоты в почках после ее фильтрации связано с 2 процессами – реабсорбцией и последующей секрецией.
Пробенецид после введения в организм поступает в кровь и доставляется в почки. Там, путем секреции он поступает в мочу, где переходит в ионизированную форму. Молекулы пробенецида связываются с белками-переносчиками анионов слабых кислот, которые обеспечивают процесс реабсорбции и секреции в мочу органических кислот. После связывания с пробенецидом эти переносчики теряют свою активность.
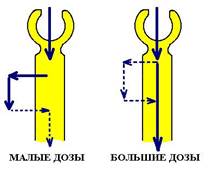 Схема 3. Влияние малых и больших доз пробенецида на выделение мочевой кислоты. Малые дозы блокируют только секрецию кислоты и ее выделение снижается. Большие дозы блокируют как секрецию, так и рабсорбцию и выделение кислоты возрастает.
Схема 3. Влияние малых и больших доз пробенецида на выделение мочевой кислоты. Малые дозы блокируют только секрецию кислоты и ее выделение снижается. Большие дозы блокируют как секрецию, так и рабсорбцию и выделение кислоты возрастает.
|
В малых дозах пробенецид блокирует те переносчики, которые осуществляют процесс секреции мочевой кислоты (они более чувствительны). При этом выделение кислоты в мочу снижается а ее абсорбция из мочи остается высокой. В итоге, уровень мочевой кислоты в организме может повыситься.
В больших дозах пробенецид блокирует переносчики которые осуществляют и реабсорбцию мочевой кислоты. В итоге, после того, как мочевая кислота путем фильтрации попадает в мочу, она уже не способна ее покинуть и экскреция мочевой кислоты возрастает.
ФЭ:
1. Урикозурическое действие. Пробенецид увеличивает выделение с мочой уратов, поэтому он особенно показан тем пациентам с подагрой, у которых экскреция уратов ниже нормы (менее 300 мг/сут). Поскольку выделение мочевой кислоты увеличивается, запасы уратов и их уровень в крови понижаются.
2. Пробенецид нарушает выведение лекарственных средств, которые, будучи слабыми кислотами, удаляются путем секреции в мочу или желчь. К таким лекарственным средствам относятся b-лактамные антибиотики, рифампицин. Поэтому, если применять пробенецид вместе с этими антибиотиками их концентрация в организме и противомикробное действие усиливаются.
Показания к применению и режим дозирования:
· Профилактика приступов подагры у пациентов, со сниженной секрецией уратов (менее 300 мг/сут). Лечение начинают с приема в дозе 250 мг 2 раза в день. При хорошей переносимости дозу повышают до 500 мг 2 раза в день. В последующем дозу повышают на 500 мг каждый месяц (максимально допустимая доза 2000 мг/сут). Если в течение 6 месяцев приступов подагры не было, дозу пробенецида можно понижать на 500 мг каждые полгода до минимально эффективной.
· Для усиления антибактериального эффекта пенициллиновой или рифампициновой терапии, продления эффекта антибиотиков (удлинения интервала между введением антибиотика) пробенецид принимают по 500 мг 4 раза в сутки у взрослых и в дозе 25 мг/кг веса у детей массой менее 50 кг.
НЭ:
1. Диспепсические расстройства: тошнота, рвота, анорексия, болезненность десен. Возникают у 2% пациентов.
2. Аллергические реакции в виде лихорадки, зуда, крапивницы. Возникают у 2-4% пациентов.
3. У 10% пациентов развивается обострение подагры в начале терапии.
4. Пробенецид нарушает транспорт анионов через ГЭБ, в т.ч. и моноаминов, b-лактамных антибиотиков. Поэтому применять его для продления действия антибиотиков у лиц с инфекционными поражениями ЦНС нерационально.
ФВ: таблетки по 500 мг.
 Сульфинпиразон (Sulfinpyrazone, Anturan) Является производным НПВС фенилбутазона. Обладает урикозурическим действием (механизм которого идентичен действию пробенецида), а также антиагрегантным эффектом. Более подробно о данном лекарственном средстве будет рассказано в разделе, посвященном антиагрегантным средствам.
Сульфинпиразон (Sulfinpyrazone, Anturan) Является производным НПВС фенилбутазона. Обладает урикозурическим действием (механизм которого идентичен действию пробенецида), а также антиагрегантным эффектом. Более подробно о данном лекарственном средстве будет рассказано в разделе, посвященном антиагрегантным средствам.
Сульфинпиразон применяется для лечения подагры в дозе 100-200 мг 2 раза в день. Каждую неделю дозу повышают на 100 мг. Эффективная доза составляет 200-800 мг/сут. Интересно отметить, что сульфинпиразон оказывает аддитивный эффект в отношении урикозурического действия пробенецида, но антагонистический в отношении урикозурического эффекта высоких доз салицилатов.
ФВ: драже по 200 мг; таблетки по 100 мг.
Бензбромарон (Benzbromarone) МД: По своему действию бензбромарон отличается от вышеописанных урикозурических средств:
· Бензбромарон высокоизбирательно блокирует уратный транспортер, который обеспечивает реабсорбцию уратов. Он не влияет на секрецию уратов и не нарушает ее в отличие от пробенецида и сульфинпиразона. Кроме того, бензбромарон не влияет на секрецию и абсорбцию других анионов.
·  Бензбромарон в высоких дозах блокирует активность фосфорибозил пирофосфат синтазы, что приводит к снижению синтеза пуринов de novo, а значит и уменьшает, в конечном итоге, образование мочевой кислоты.
Бензбромарон в высоких дозах блокирует активность фосфорибозил пирофосфат синтазы, что приводит к снижению синтеза пуринов de novo, а значит и уменьшает, в конечном итоге, образование мочевой кислоты.
Полагают, что в печени бензбромарон образует активные метаболиты – бензурон и бромбензарон, с которыми связан основной терапевтический эффект лекарства.
ФЭ: Бензбромарон сочетает в себе урикозурическое и урикостатическое действие. Эффект лекарства развивается только через 24 ч, что связано с необходимостью синтеза в печени фармакологически активных метаболитов лекарства.
Применение и режимы дозирования. Для профилактики приступов подагры у лиц со сниженной секрецией уратов бензбромарон применяют по 50-200 мг/сут. По эффективности урикозурического действия бензбромарон превосходит эффект пробенецида и сульфинпиразона.
НЭ: Возможно развитие кожных аллергических реакций, обострение течения подагры в начале лечения.
При лечении урикозурическими средствами следует помнить о том, что повышение секреции уратов с мочой приводит к тому, что они могут выпадать в ней в виде кристаллов и провоцировать рост уратных камней. Поэтому в течении всего периода лечения пациент должен поддерживать суточный диурез не менее 2 литров, а реакцию мочи в пределах 6,4-6,8 (это будет способствовать лучшей растворимости уратов).
ФВ: таблетки по 100 мг.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 641; Нарушение авторских прав?; Мы поможем в написании вашей работы!