
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Белки BRCA1 и BRCA2
|
|
|
|
Белки BRCA1 и BRCA2, гетерозиготное носительство мутаций в генах которых приводят к наследственным формам рака груди, также вовлечены в процесс репарации DSB. Многими авторами показано, что они выявляются в фокусах репарации методами иммунопреципитации. Эти белки не являются гомологами и выполняют в клетках различные функции. Мыши, нокаутные по этим генам гибнут еще во время эмбрионального развития.
На схеме строения BRCA1 (1863 аминокислоты) и BRCA (3418 аминокислот), изображенной на рис. 28, видны ключевые домены обоих белков. Это неродственные белки. BRCA1 имеет BRCТ-мотив в С-конце (вероятно, служащий для белок-белковых взаимодействий и организации репарационных ферментов в комплексы), SQ-кластер, в котором расположены сайты фосфорелирования этого белка белками ATM и ATR, и ринг-домен на N-конце, также служащий для белок-белковых взаимодействий.
Для BRCA2 характерен очень большой 11 экзон, содержащий 8 BRC-повторяющихся мотивов, необходимых для связывания белка RAD51. Фрагмент BRCA2, содержащий аминокислотные остатки 788-1064, образует комплекс с RAD51, и с помощью иммунофлуоресцентного окрашивания удалось показать, что оба белка локализованы in vivo в одних и тех же элементах синаптонемного комплекса.
Мыши, нокаутные по этим генам гибнуть еще во время эмбрионального развития.

Рисунок 28. Схематическое изображение белков BRCA1 и BRCA2.
BRCA1 и BRCA2 обнаружены только у высших эукариот, что говорит о роли этих белков в организации сложных мультибелковых комплексов, участвующих во все более усложняющихся реакциях увеличивающихся геномов и способных вовлекаться в разнообразные клеточные процессы и связывать их между собой.
Продукт гена BRCA1 (опухолевого гсна-супрессора) обладает ярко выраженной способностью к образованию комплексов с другими белками. Многочисленные белки репарации ДНК – BRCA1, MSH2, MSH6, MLH1, ATM, BLM и комплекс RAD50-MRE11-NBS1 могут быть обнаружены при совместной иммунопреципитации с ним в рамках единого комплекса, называемого BRCA1-associated surveillance complex (BASC). По современным представлениям BRCA1 совместно с комплексом Mre11-RAD50-NBS1 (MRN) являются основными белками – сенсорами, которые участвуют в распознавании двунитевых разрывов ДНК. BRCA1 взаимодействует с большим числом других белков, вовлеченных в процессы репарации ДНК, и служит якорем и координатором для дальнейшей сборки уже упомянутого белкового комплекса BASC, и, вероятно, одновременно является адаптором, предоставляющим дополнительные мишени для фосфорелирования киназам-переносчикам сигнала.
Многие белки, участвующие в передаче сигнала о повреждении ДНК и называемые медиаторами, содержат два повторяющихся домена, обнаруженных впервые в С-конце белка BRCA1 и названных поэтому BRCТ-доменами. Их обычно называют BRCТ-содержащими белками, они вовлечены в чекпойнт-ответ, распознают повреждения ДНК и привлекают другие белки, которые облегчают передачу сигнала вниз по сигнальному пути и репарацию ДНК. Это TopBP1 (topoisomerase II binding protein I), 53BP1 (P53 binding protein I) и MDC1 (mediator of DNA damage checkpoint protein I), белок Rad9 дрожжей, известный своей ролью в контроле клеточного цикла. BRCТ-домены имеют и уже упоминавшиеся ДНК-полимеразы λ и μ.
В тоже время белок BRCA1 способен к убиквитин-лигазной активности, которую он проявляет в комплексе с особым белком BARD1 (BRCA1-assosiated RING-domain protein 1). Белок BARD1, связываясь с белком Р53 и принимая участие в его стабилизации, является одним из триггеров апоптоза. Во время S-фазы клеточного цикла белки BRCA1, BARD1 и RAD51 находятся в единых комплексах, выявляемых как “BRCA1 nuclear dots”, и при повреждении ДНК в этой фазе мигрируют в зону репаративной реакции.
Наследственные мутации в другом супрессорном гене, BRCA2, ответственны в 50 % случаев за предрасположенность к раннему развитию рака молочной железы у женщин. Мышиные эмбрионы с дефектным геном BRCA2 обладают повышенной чувствительностью к γ-лучам и погибают на ранних стадиях развития. С-концевой фрагмент (36 аминокислотных остатков) белка BRCA2 мыши (всего 3328 остатка) взаимодействует с N-концевым районом белка mRad5l мыши (43 аминокислотных остатка). Гены, кодирующие белки BRCA2 и mRad5I, экспрессируются в эмбрионах одновременно, поэтому очевидна функциональная значимость этого взаимодействия.
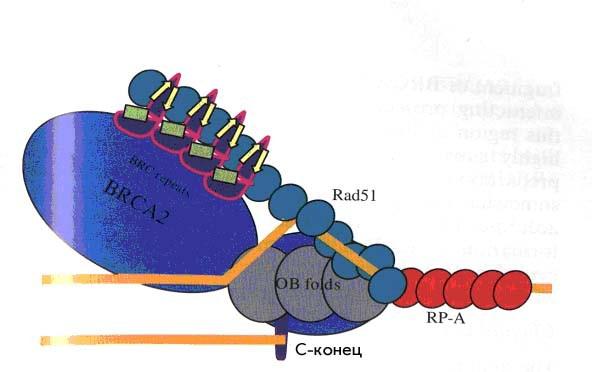
Рисунок 29. Взаимодействие между белками BRCA2 и hRAD51.
На рис. 29 показано, как именно RAD51 человека взаимодействует с районом BRC повтора, где происходит взаимопроникновение между мономерами RAD51 и BRCА2. Предполагается, что при этом взаимодействии мономеры RAD51 выстраиваютсяв одну линии на области BRC повтора, в то время как «хвостовой» С-конец белка (800 аминокислот) BRCA2 человека связывается с однонитевой ДНК. Этот хвост отделен от района BRC-повтора областью, сотоящей из трех олигонуклеотид-связывающих доменов (ОВ1ОВ2ОВ3), способных связываться с онДНК и «башней» между ОВ2 и ОВ3, содержащей трехспиральный узел, и так образует целый комплекс, способный смещать RPA и заменять его RAD51-филаментом. Причем надо заметить, что строение ОВ2ОВ3 доменов достоверно сходно со строением белка RPA.
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 638; Нарушение авторских прав?; Мы поможем в написании вашей работы!