
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Количественные характеристики вещества
|
|
|
|
Положения атомно-молекулярной теории.
Основные законы и понятия химии
1. Все вещества состоят из молекул, атомов или ионов.
Молекула – наименьшая частица вещества, обладающая его химическими свойствами. Молекулы состоят из атомов.
Атом –наименьшая частица химического элемента, обладающая его химическими свойствами. Атом состоит из ядра и электронов. Ядро состоит из протонов и нейтронов.
Ион – отрицательно или положительно заряженная частица, образующаяся при отрыве или присоединении электрона к нейтральному атому:
Na – 1 e– = Na+; Cl +1 e– = Cl–
Химический элемент – вид атомов с одинаковым зарядом ядер и с присущим только ему строением электронных оболочек. Различным элементам соответствуют разные атомы.
2. Молекулы и атомы находятся в непрерывном движении, их скорость возрастает с увеличением температуры.
3. Между молекулами в веществе существуют силы взаимного притяжения и отталкивания.
4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ – из разных атомов.
5. Атомы и молекулы имеют массу и размеры.
Массы атомов химических элементов очень малы. Например, абсолютная масса атома кислорода составляет 2,667 · 10-26 кг. Пользоваться такими значениями в расчетах очень неудобно, поэтому на практике вместо абсолютных масс атомов используют относительные атомные массы. В 1961 г. была принята единая шкала относительных атомных масс, в основе которой лежит атомная единица массы (а.е.м.). А.е.м. – величина, равная 1/12 абсолютной массы атома углерода – 12С:
1 а.е.м. =  · mа (12С) =
· mа (12С) =  · 1,993·10-26 кг = 1,66·10-27 кг.
· 1,993·10-26 кг = 1,66·10-27 кг.
Относительная атомная масса (Ar) – безразмерная величина, равная отношению средней массы атома элемента (естественного изотопа) к атомной единице массы.
Относительная молекулярная масса (Мr) вещества – безразмерная величина, равная отношению массы его молекулы к атомной единице массы. Мr равна сумме относительных атомных масс всех элементов (Э) с учётом индексов:
| Mr = ∑Ar (Э). | (2.2.1) |
Количество вещества (n) – величина, прямо пропорциональная числу структурных единиц (атомов, молекул, ионов и др.) в системе. Единицей измерения количества вещества является моль.
Моль – количество вещества, содержащее столько молекул, атомов, ионов или других структурных единиц, сколько атомов содержится в 12 граммах изотопа углерода 12С.
Количество частиц (атомов, ионов, молекул), содержащееся в 1 моле вещества равно 6,02∙1023 моль-1 и называется постоянной Авогадро (N a).
Молярная масса (М) – это масса 1 моля вещества. Молярная масса вещества и количество вещества связаны соотношением:
n 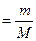 , откуда , откуда 
| (2.2.2) |
Единицей измерения молярной массы является г/моль и кг/моль. Молярная масса любого вещества М численно равна его относительной молекулярной массе Мr, а для атома простого вещества – его относительной атомной массе Аr.
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 2862; Нарушение авторских прав?; Мы поможем в написании вашей работы!