
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы определения молярной массы газов
|
|
|
|
Существует ряд методов определения молекулярной массы газов при определенных внешних параметрах: давлении (Р), объеме (V) и температуре (Т).
1. По закону Авогадро и следствиям из него
Закон Авогадро: в равных объемах различных газов при одинаковых температуре и давлении содержится одинаковое число молекул.
Следствие 1: один моль любого вещества содержит количество структурных единиц данного вещества, равное постоянной Авогадро (Na = 6,02∙1023 моль-1).
Следствие 2: при нормальных условиях (н.у.) (Р = 105 Па, Т = 273 К) один моль любого газа занимает объем 22,4 л. Эта величина получила название молярный объем (VM).
Зная массу m (г) какого-либо объема газа при н.у. и его объем V0 (л), можно рассчитать его молекулярную массу.
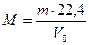 . .
| (2.3.1) |
Следствие 3: массы равных объемов двух газов, взятых при одинаковых давлении и температуре, относятся друг к другу, как их молярные массы:
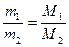 . .
| (2.3.2) |
Отношение массы определенного объема первого газа к массе такого же объема второго газа (взятого при тех же условиях) называется относительной плотностью первого газа по второму (D). Тогда:
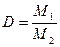 . .
| (2.3.3) |
Обычно плотность газа определяют по отношению к водороду (D H2) или воздуху (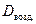 .). Тогда:
.). Тогда:
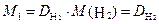 · 2, · 2,
| (2.3.4) |
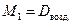 М возд. = М возд. = 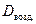 ·29. ·29.
| (2.3.5) |
С учётом вышеуказанных условий для расчёта количества вещества используют следующие соотношения:
n 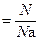 , ,
| (2.3.6) |
где N – количество структурных единиц в системе;
n 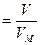 , ,
| (2.3.7) |
где VM – молярный объём.
2. По уравнению Клапейрона – Менделеева
Если условия, в которых находится газ, отличны от нормальных, то параметры газа определяют по уравнению Клапейрона – Менделеева:
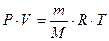 , ,
| (2.3.8) |
тогда молекулярную массу газа рассчитывают по формуле: 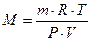 . .
| (2.3.9) |
Единицы измерения величин в данном уравнении зависят от того, в каких единицах выражена масса (табл.1.2.1).
Таблица 2.3.1
Единицы измерения величин в уравнении
Менделеева-Клапейрона
| Обозначение | Название величины | Единицы измерения | |
| СИ | CDSE | ||
| m | масса | кг | г |
| M | молярная масса | кг/моль | г/моль |
| P | давление | Па | мм. рт. ст. |
| V | объем | м3 | мл |
| T | температура | К | К |
| R | универсальная газовая постоянная | 8,31 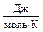
| 62400 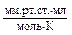
|
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 2900; Нарушение авторских прав?; Мы поможем в написании вашей работы!