
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реактивы, посуда, оборудование
|
|
|
|
Водопроводная вода; индикаторы: метилоранж, эриохром черный ЭТ-00; растворы 0,1н НС1; трилон Б, аммиачно-буферная смесь (NH4OH +NH4C1).
Колбы конические емкостью 250 см3; мерные цилиндры (мензурки) емкостью 50 и 100см3; бюретки емкостью 25 и 50см3; пипетки емкостью 5, 50 и 100 см3.
Опыт № 1. Определение временной жесткости воды.
Временную, или карбонатную жесткость воды можно определить кислотно-основным титрованием. Концентрация НСО 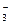 в воде определяется титрованием раствором НСl:
в воде определяется титрованием раствором НСl:
НСО 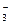 + Н+=Н2О + СО2↑,
+ Н+=Н2О + СО2↑,
Са(НСО3)2 +НС1 = СаС12 +2H2O+2CO2↑
Ход исследования
В две конические колбы на 250 см3 отобрать пипеткой или мензуркой по 100 см3 исследуемой воды. Внести в каждую по 2-3 капли метилоранжа. Одна из проб контрольная. Из бюретки по каплям приливать в одну колбу 0,1н раствор соляной кислоты до тех пор, пока от одной капли кислоты окраска перейдет из желтой в розовую. Сравните цвета растворов в колбах с исследуемой пробой и контрольной. Титрование повторите 2 – 3 раза. Взяв средний расход кислоты, рассчитайте карбонатную жесткость по формуле:
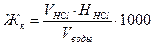 ,
,
где Жк - карбонатная (временная) жесткость, мэкв/л, Vводы - объем воды, см3,
VHC1 - объем соляной кислоты, пошедшей на титрование, см3, ННС1 - нормальность соляной кислоты, г экв/л.
Опыт № 2. Определение общей жесткости воды.
Общая жесткость воды определяется комплексонометрическим титрованием. Вода с солями жесткости титруется раствором комплексона, чаще всего раствором этилендиаминотетрауксусной кислоты (EДТА, комплексона II) или ее двунатриевой соли (комплексона III или трилона Б). Состав трилона Б выражается формулой:

 НООС – СH2 CH2COONa
НООС – СH2 CH2COONa

 N-CH2-CH2-N
N-CH2-CH2-N
НООС – CH2 CH2COONa.
Реакции образования комплексных солей, происходящие при титровании воды, содержащей ионы Са2+, Mg2+ и др., трилоном Б, могут быть выражены следующими сокращенными уравнениями:
Na2H2 трил. + Ca2+ = Na2 [Ca трил.] + 2Н+
Na2H2 трил. + Mg2+ = Na2 [Mg трил.] + 2Н+
где трилон является лигандом.
В качестве индикатора применяется краситель - эриохром черный, ЭТ-00, образующий с ионами Mg2+, Са2+ и др., окрашенные малодиссоциирующие комплексные соединения. Эриохром черный представляет собой кислоту и действует как кислотно - основной индикатор с изменением окраски в зависимости от рН среды.
При титровании воды трилон Б сначала реагирует со свободными ионами Са2+, затем со свободными ионами Mg2+ и, наконец, извлекает Mg2+из его соединения с индикатором, изменяя окраску индикатора из вишнево-красной в фиолетовую, затем в синюю (окраска индикатора в щелочной среде при отсутствии ионов Mg2+).
Величина рН раствора около 10 является лучшей для титрования. Для создания такой среды к анализируемой пробе воды добавляют аммиачно — буферную смесь -NH4 ОН +NH4C1. При рН = 10 переход окраски очень резкий, вследствие чего титрование осуществляется с большой точностью.
Ход исследования
В две конические колбы на 250 см3 отмерить пипеткой или мензуркой по 100 см3 исследуемой воды, добавить в каждую пипеткой по 5 см3 аммиачно-буферного раствора и 7-8 капель раствора эриохрома черного (ЭТ-00). Перемешать растворы. Одна из проб контрольная. Во второй колбе исследуемую пробу титровать 0,1н раствором трилона Б до перехода красно-вишневой окраски в фиолетовую. Затем по каплям при тщательном перемешивании титровать до появления синей окраски. Сравнить цвета исследуемой оттитрованной пробы с контрольной. Опыт повторите 2-3 раза и возьмите среднее значение трилона Б, пошедшего на титрование. Определение общей жесткости Жо6щ произвести по формуле:

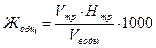 ,
,
где Vтр - объем трилона Б, пошедший на титрование пробы воды, см3;
Нтр - нормальность трилона, г экв/л;
Vводы - объем пробы воды, см3.
Постоянную жесткость воды определите по разности между общей и карбонатной жесткостью:
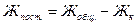
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 470; Нарушение авторских прав?; Мы поможем в написании вашей работы!